题目内容
18.0.5L 0.2mol/L的Al2(SO4)3中含有n(Al3+)0.2 mol,m(SO42-)28.8g.某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是0.025mol.
分析 0.2mol/L的Al2(SO4)3中c(Al3+)=0.4mol/L、c(SO42-)=0.6mol/L,根据n=cV计算n(Al3+)、n(SO42-),再根据m=nM计算m(SO42-);
根据n=$\frac{N}{{N}_{A}}$计算n(Na+),溶液中n(Na+)=2n(SO42-).
解答 解:0.2mol/L的Al2(SO4)3中c(Al3+)=0.4mol/L、c(SO42-)=0.6mol/L,则:n(Al3+)=0.5L×0.4mol/L=0.2mol,n(SO42-)=0.5L×0.6mol/L=0.3mol,m(SO42-)=0.3mol×96g/mol=28.8g;
3.01×1022个Na+的物质的量为$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.05mol,溶液中n(Na+)=2n(SO42-),故n(SO42-)=0.025mol,
故答案为:0.2;28.8;0.025.
点评 本题考查物质的量有关计算,比较基础,注意理解掌握电解质溶液中离子浓度与电解质浓度关系.

练习册系列答案
相关题目
6.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 在燃煤时加入石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO4+2CO2 | |
| B. | 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| D. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++PbS═CuS+Pb2+ |
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2═Na2SO4
2Na2O2+2SO3═2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
2Na2O2+2SO3═2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
| A. | 2Na2O2+2N2O4═4NaNO3 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3═4NaNO2+O2 | D. | 2Na2O2+2 Mn2O7═4Na2MnO4+O2 |
7.下列物质的转化在给定条件下不能实现的是( )
| A. | A、Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{NaOH(aq)}{→}$Na2SiO3 |
8.下列叙述中正确的是( )
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
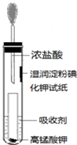 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答: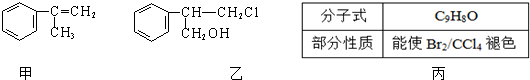
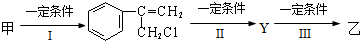
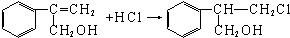 (不需注明反应条件).
(不需注明反应条件).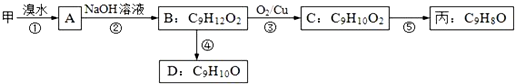
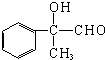 ;丙的结构简式为
;丙的结构简式为 .
. 、
、 、
、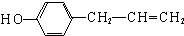 其中一种.
其中一种.