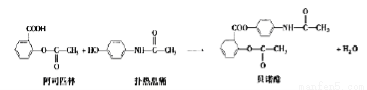
题目内容
9.某固体粉末含Fe3O4、CuCO3、Cu2O、Al2O3、MgCO3一种或几种,某化学兴趣小组按如下方案进行实验探究. 已知:Cu2O+2HCl=Cu+CuCl2+H2O,下列对实验结果的分析合理的是( )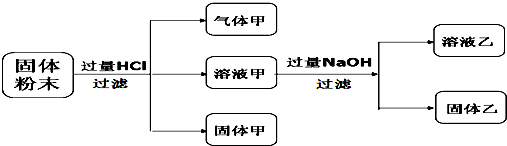
| A. | 溶液乙中溶质至少2种及以上 | |
| B. | 固体乙中成分至少2种及以上 | |
| C. | 固体粉末中一定含有Cu2O、Al2O3、MgCO3 | |
| D. | 溶液甲中可能含有Fe3+ |
分析 固体粉末加入过量盐酸生成气体甲,则气体甲一定为CO2,应含有碳酸盐,与盐酸反应后有固体甲生成,则由反应可知Cu2O+2HCl=Cu+CuCl2+H2O,原固体中含有Cu2O,固体甲含有Cu,溶液甲中含有Cu2+,固体乙中一定含有Cu(OH)2,溶液乙中含有NaCl、NaOH,样品含有Al2O3,则溶液乙中还含有NaAlO2,以此解答该题.
解答 解:固体粉末加入过量盐酸生成气体甲,则气体甲一定为CO2,应含有碳酸盐,与盐酸反应后有固体甲生成,则由反应可知Cu2O+2HCl=Cu+CuCl2+H2O,原固体中含有Cu2O,固体甲含有Cu,溶液甲中含有Cu2+,固体乙中一定含有Cu(OH)2,溶液乙中含有NaCl、NaOH,样品含有Al2O3,则溶液乙中还含有NaAlO2,
A.由以上分析可知,溶液乙中溶质至少2种及以上,故A正确;
B.固体乙中一定含有Cu(OH)2,其它不能确定,故B错误;
C.固体中含有Cu2O,CuCO3、MgCO3至少一种,不能确定是否含有Al2O3,故C错误;
D.加入盐酸后生成的固体甲中含有Cu,则溶液甲中一定不含Fe3+,故D错误.
故选A.
点评 本题无机物的推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,题目侧重于元素化合物知识的综合理解和运用的考查,注意把握反应的现象,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.某二元酸(化学式H2A)在水中的电离方程式是H2A→H++HA-、HA?H++A2-又知0.1mol/L NaHA溶液的pH=2.则下列说法不正确的是( )
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |
2.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.以Al-H2O2燃料电池电解尿素的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下列说法不正确的是( )
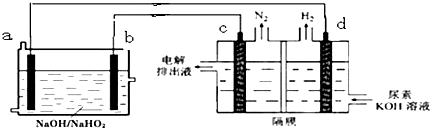

| A. | 电解过程中,电子的流向由a→b→c→d | |
| B. | 电极b是正极,且反应后该电极区pH增大 | |
| C. | 燃料电池的总反应为:2Al+3HO2-=2AlO2-+OH-+H2O | |
| D. | 电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
19.下列有关离子方程式正确的是( )
| A. | 向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
20.下列关于元素周期表的结构的叙述中正确的是( )
| A. | 除短周期外,其他周期均有18种元素 | |
| B. | 副族元素中没有非金属元素 | |
| C. | 周期表中的第三列是ⅢA | |
| D. | 在过渡元素区能找到大量单质半导体材料 |
17.将一定量的醇等分成两份,取一份充分燃烧可生成0.2mol CO2,另一份与足量Na作用放出0.1mol H2,则该醇不可能是( )
| A. | 甲醇 | B. | 乙二醇 | C. | 异丙醇 | D. | 甘油 |

 N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0