题目内容
17.将一定量的醇等分成两份,取一份充分燃烧可生成0.2mol CO2,另一份与足量Na作用放出0.1mol H2,则该醇不可能是( )| A. | 甲醇 | B. | 乙二醇 | C. | 异丙醇 | D. | 甘油 |
分析 已知2-OH→H2,题目中n(H2):n(CO2)=1:2,说明分子中-OH和C原子数相等,以此可用排除法解答该题.
解答 解:已知2-OH→H2,题目中n(H2):n(CO2)=1:2,说明分子中-OH和C原子数相等,则饱和醇可为甲醇、乙二醇、丙三醇等,而异丙醇中-OH和C原子数不等,不符合题意.
故选C.
点评 本题考查有机物的推断,题目难度不大,本题注意把握题中生成氢气和二氧化碳的物质的量关系为解答该题的关键.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
10.已知乙醇、石墨和氢气的燃烧热分别为a、b、c (均为正值,单位均为kJ•mol-1).则反应2C(石墨,s)+2H2(g)+H2O(l)=C2H5OH(l)的焓变为( )
| A. | ( 2b+2c-a)kJ•mol-1 | B. | (a-2b-2c) kJ•mol-1 | ||
| C. | (b+c-a) kJ•mol-1 | D. | (a-2b-c) kJ•mol-1 |
9.某固体粉末含Fe3O4、CuCO3、Cu2O、Al2O3、MgCO3一种或几种,某化学兴趣小组按如下方案进行实验探究. 已知:Cu2O+2HCl=Cu+CuCl2+H2O,下列对实验结果的分析合理的是( )
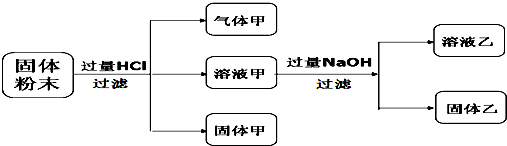

| A. | 溶液乙中溶质至少2种及以上 | |
| B. | 固体乙中成分至少2种及以上 | |
| C. | 固体粉末中一定含有Cu2O、Al2O3、MgCO3 | |
| D. | 溶液甲中可能含有Fe3+ |
12.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 对“地沟油”进行分馏可以获得汽油发动机的燃料 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 | |
| D. | 工业上氯气和澄清石灰水为原料制造漂白粉 |
2.下列说法正确的是( )
| A. | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | |
| B. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| C. | 邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
9.等物质的量的乙烷、乙烯、乙炔完全燃烧消耗氧气的物质的量之比为( )
| A. | 1:1:1 | B. | 30:35:42 | C. | 5:4:3 | D. | 7:6:5 |
1.据相关报道,在日本生产的婴儿奶粉中检测到铯的人工放射性核素.下列说法正确的是( )
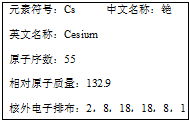

| A. | 133Cs的核电荷数为133 | B. | 133Cs+核外有54个电子 | ||
| C. | 133Cs的质子数比137 Cs少4个 | D. | 铯与水的反应比钠与水的反应缓慢 |
2.四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
试回答下列问题:(用相关元素符号、化学式等化学用语回答)
(1)元素Z位于周期表中第三周期VA族.
(2)这些元素的最简单氢化物中,相同条件下最易溶于水的是NH3(写化学式),写出该最简单氢化物与该元素的最髙价氧化物的水化物反应的离子方程式NH3+H+=NH4+.
(3)XW2的电子式为 .
.
(4)W的最高价氧化物的化学式为SO3;Y的一种氧化物YO2对环境的危害有光化学烟雾(任意写一种),试写出Y02与水反应的化学方程式3NO2+H2O=2HNO3+NO
(5)Z形成的四核单质分子形状是正四面体,其晶体类型是分子晶体;其晶体内部存在的微
粒间相互作用有分子间作用力、共价键.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期VA族.
(2)这些元素的最简单氢化物中,相同条件下最易溶于水的是NH3(写化学式),写出该最简单氢化物与该元素的最髙价氧化物的水化物反应的离子方程式NH3+H+=NH4+.
(3)XW2的电子式为
 .
.(4)W的最高价氧化物的化学式为SO3;Y的一种氧化物YO2对环境的危害有光化学烟雾(任意写一种),试写出Y02与水反应的化学方程式3NO2+H2O=2HNO3+NO
(5)Z形成的四核单质分子形状是正四面体,其晶体类型是分子晶体;其晶体内部存在的微
粒间相互作用有分子间作用力、共价键.
 .
.