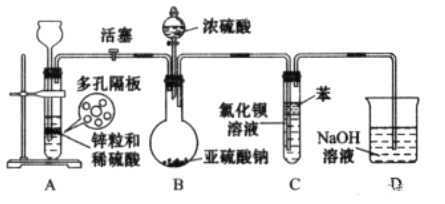
题目内容
【题目】一种生产高氯酸(HClO4)的工艺流程如图所示,该流程同时产出重要含氯消毒剂(ClO2)和漂白剂亚氯酸钠(NaClO2):
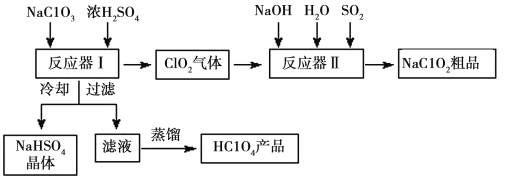
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是一种强酸,沸点130℃左右。.
请回答下列问题:
(1)完成反应器1中生成高氯酸的化学方程式:NaClO3+H2SO4=HClO4+__ClO2↑+NaHSO4+![]() ___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
___。冷却的目的是__,能用蒸馏法分离出高氯酸的原因是___。
(2)反应器II中发生反应的离子方程式为___。
(3)通入反应器II中的SO2用H2O2代替同样能生成NaClO2,请简要说明H2O2能代替SO2的原因是___。
【答案】3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O 降低NaHSO4的溶解度,使NaHSO4结晶析出 HClO4沸点低,且与滤液中其他成分沸点差异较明显 2ClO2+SO2+4OH-=2![]() +
+![]() +2H2O H2O2有还原性,也能把ClO2还原为NaClO2
+2H2O H2O2有还原性,也能把ClO2还原为NaClO2
【解析】
(1) 根据得失电子守恒和原子守恒,书写出化学反应方程式;冷却的目的是是利用NaHSO4溶解度来冷却结晶;用蒸馏法分离混合物是因为两者的沸点相差明显;
(2) 根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,根据氧化还原反应的得失电子守恒,和质量守恒定律来配平离子方程式;
(3) SO2用H2O2代替同样能生成NaClO2,因为H2O2与SO2一样具有还原性。
(1)反应中Cl元素的化合价部分由+5价升至+7价、部分由+5价降至+4价,根据得失电子守恒和原子守恒,书写出化学反应方程式为:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;因为硫酸氢钠的溶解度随温度的升高而增大,将反应生成物的溶液冷却得到NaHSO4晶体,过滤后,将滤液蒸馏得到纯净的HClO4,是因为高氯酸的沸点低,且与滤液中其他成分沸点差异较明显,故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;降低NaHSO4的溶解度,使NaHSO4结晶析出;HClO4沸点低,且与滤液中其他成分沸点差异较明显;
(2) 根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理:氧化剂得到电子总数等于还原剂失去电子的总数,则氧化还原反应方程式为:2ClO2+SO2+4OH-=2![]() +
+![]() +2H2O,故答案为:2ClO2+SO2+4OH-=2
+2H2O,故答案为:2ClO2+SO2+4OH-=2![]() +
+![]() +2H2O;
+2H2O;
(3) 如果将反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为NaClO2,故答案为:H2O2有还原性,也能把ClO2还原为NaClO2。

【题目】400℃时,向一个容积为2L的密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。反应过程中测得的部分数据见下表:
CH3OH(g)。反应过程中测得的部分数据见下表:
t/min | 0 | 10 | 20 | 30 |
n(CO)/mol | 0.20 | 0.08 | 0.04 | |
n(H2)/mol | 0.40 | 0.08 |
下列说法不正确的是
A. 反应在前10min内的平均速率为v(H2)=0.012 mol/(L·min)
B. 400℃时,该反应的平衡常数数值为2.5×103
C. 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.06mol·L-1,则反应的ΔH<0
D. 相同温度下,若起始时向容器中充入0.3mol CH3OH,达到平衡时CH3OH的转化率大于20%