题目内容
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 3.041 | 1.000 | 0.120 |
由表中数据判断△H 0(填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300℃时,在体积为2.0L的密闭容器中通入2mol CO和4mol H2,经过20s 达到平衡状态,
①计算20s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,平衡移动情况是
(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H3=﹣44kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
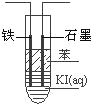
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH.
【答案】(1)<; ;
;
(2)①0.025mol/(Ls);25%;②向右;若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,此时浓度c(CO)=0.5mol/L+![]() mol/L=1mol/L,n(H2)=2(1﹣0.5)mol/L+
mol/L=1mol/L,n(H2)=2(1﹣0.5)mol/L+![]() =2mol/L,c(CH3OH)=0.5mol/L+
=2mol/L,c(CH3OH)=0.5mol/L+![]() =1mol/L,计算此时浓度上海Qc=
=1mol/L,计算此时浓度上海Qc=![]() =0.25<K=1,平衡向右移动;
=0.25<K=1,平衡向右移动;
(3)CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣443.5KJ/mol;
(4)CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O;负;紫红;0.053g.
【解析】(1)随温度升高平衡常数减小,升温平衡逆向进行,正反应为放热反应,△H<0,CO(g)+2H2(g)CH3OH(g),K= ,
,
(2)①300℃时,在体积为2.0L的密闭容器中通入2mol CO和4mol H2,经过20s 达到平衡状态,结合化学平衡三行计算列式计算,300℃时平衡常数=1,设CO消耗浓度x,
CO(g)+2H2(g)CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) x 2x x
平衡量(mol/L)1﹣x 2﹣2x x
![]() =1
=1
x=0.5mol/L,
20s内CO的反应速率=![]() =0.025mol/(Ls),
=0.025mol/(Ls),
此时容器中甲醇的体积分数=![]() ×100%=25%,
×100%=25%,
②若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,此时浓度c(CO)=0.5mol/L+![]() mol/L=1mol/L,n(H2)=2(1﹣0.5)mol/L+
mol/L=1mol/L,n(H2)=2(1﹣0.5)mol/L+![]() =2mol/L,c(CH3OH)=0.5mol/L+
=2mol/L,c(CH3OH)=0.5mol/L+![]() =1mol/L,
=1mol/L,
计算此时浓度上海Qc=![]() =0.25<K=1,反应正向进行,平衡移动情况是向右,
=0.25<K=1,反应正向进行,平衡移动情况是向右,
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H3=﹣44kJ/mol,
盖斯定律计算得到:( )①﹣②+4×③)×![]() 写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣443.5KJ/mol,
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣443.5KJ/mol,
(4)甲醇燃料碱性电池中,甲醇在负极上发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与电源负极相连,通电一段时间后,断开电源,振荡试管,碘单质溶于苯,上层溶液为紫红色,当有1.27g 碘单质生成时,n(I2)=![]() =0.005mol,电子守恒:2I﹣﹣2e﹣=I2,CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O,CH3OH~6e﹣~3I2,
=0.005mol,电子守恒:2I﹣﹣2e﹣=I2,CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O,CH3OH~6e﹣~3I2,
甲醇物质的量=![]() mol,质量=
mol,质量=![]() mol×32g/mol=0.053g,
mol×32g/mol=0.053g,