��Ŀ����
����Ŀ��Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ)��Cr(OH)4(��ɫ)��Cr2O72(�Ⱥ�ɫ)��CrO42(��ɫ)����ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
��1��Cr3+��Al3+�Ļ�ѧ�������ơ���Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������_________��
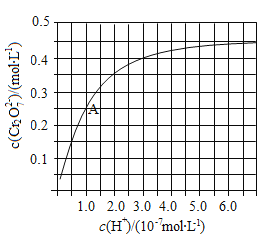
��2��CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol![]() L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ____________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����__________(�������С�����䡱)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__________��
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H______0(����ڡ���С�ڡ����ڡ�)��
��3���ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ��Cl������Ag+��CrO42����ש��ɫ������ָʾ����ζ��յ㡣����Һ��Clǡ�ó�����ȫ(Ũ�ȵ���1.0��105 mol��L1)ʱ����Һ��c(Ag+)Ϊ_______ mol![]() L1����ʱ��Һ��c(CrO42)����__________ mol
L1����ʱ��Һ��c(CrO42)����__________ mol![]() L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
L1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
��4��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72��ԭ��Cr3+���÷�Ӧ�����ӷ���ʽΪ______________��
���𰸡���1������ɫ��Һ��dz��ͬʱ�л���ɫ�������ɣ�Ȼ��������ܽ��γ���ɫ��Һ��
��2����2CrO42-+2H��![]() Cr2O72-+H2O�� �� ����1.0��1014 ��������
Cr2O72-+H2O�� �� ����1.0��1014 ��������
��3��2.0��10-5 ��5��10-3����4��Cr2O72+3HSO3 +5H��=2Cr3++3SO42+4H2O��
����������1������Cr3+��Al3+�Ļ�ѧ�������ƣ���֪Cr(OH)3����������������ܽ���ǿ��NaOH��Һ�С���Cr2(SO4)3��Һ����μ���NaOH��Һֱ�����������ȷ�����Ӧ��Cr3++3OH-=Cr(OH)3��������Cr(OH)3����ɫ���壬�������ʱ���ֻᷢ����Ӧ��Cr(OH)3+OH-= Cr(OH)4���ɹ۲쵽������ʧ����Һ��Ϊ��ɫ���ʹ۲쵽������Ϊ����ɫ��Һ��dz��ͬʱ�л���ɫ�������ɣ�Ȼ��������ܽ��γ���ɫ��Һ����2��������H+Ũ�ȵ�����CrO42-����Һ�е�H+������Ӧ����Ӧת��ΪCr2O72-�����ӷ�ӦʽΪ��2CrO42-+2H��![]() Cr2O72-+H2O���ڸ��ݻ�ѧƽ���ƶ�ԭ������Һ��������c(H+)����ѧƽ��2CrO42-+2H��
Cr2O72-+H2O���ڸ��ݻ�ѧƽ���ƶ�ԭ������Һ��������c(H+)����ѧƽ��2CrO42-+2H��![]() Cr2O72-+H2O������Ӧ������У�����CrO42��ƽ��ת����������ͼ���֪����A��ʱ��c(Cr2O72-)=0.25 mol/L�����ڿ�ʼʱc(CrO42)=1.0 mol/L������CrԪ���غ��֪A�����Һ��CrO42-��Ũ��c(CrO42)=0.5 mol/L��H+Ũ��Ϊ1.0��10-7 mol/L����ʱ��ת����Ӧ��ƽ�ⳣ��Ϊ
Cr2O72-+H2O������Ӧ������У�����CrO42��ƽ��ת����������ͼ���֪����A��ʱ��c(Cr2O72-)=0.25 mol/L�����ڿ�ʼʱc(CrO42)=1.0 mol/L������CrԪ���غ��֪A�����Һ��CrO42-��Ũ��c(CrO42)=0.5 mol/L��H+Ũ��Ϊ1.0��10-7 mol/L����ʱ��ת����Ӧ��ƽ�ⳣ��Ϊ![]() �������������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С��˵�������¶ȣ���ѧƽ�������ƶ���������Һ��CrO42��ƽ��ת���ʼ�С������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ�����Ը÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ʸ÷�Ӧ�Ħ�H��0����3������Һ��Cl��ȫ����ʱ����c(Cl-)=1.0��105 mol��L1�������ܶȻ�����Ksp(AgCl)=2.0��1010���ɵ���Һ��c(Ag+)=Ksp(AgCl)��c(Cl-)=2.0��1010��(1.0��105 mol��L1)=2.0��10-5 mol��L1�����ʱ��Һ��c(CrO42)=Ksp(Ag2CrO4)/c2(Ag+)=2.0��1012��(2.0��10-5 mol��L1)=5��10-3mol��L1����4�� NaHSO3���л�ԭ�ԣ�Cr2O72���������ԣ����ᷢ��������ԭ��Ӧ��������֪��������ϵ����غ㡢����غ㡢ԭ���غ㣬�ɵö��߷�Ӧ�����ӷ���ʽΪ��Cr2O72+3HSO3 +5H��=2Cr3++3SO42+4H2O��
�������������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С��˵�������¶ȣ���ѧƽ�������ƶ���������Һ��CrO42��ƽ��ת���ʼ�С������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ�����Ը÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ʸ÷�Ӧ�Ħ�H��0����3������Һ��Cl��ȫ����ʱ����c(Cl-)=1.0��105 mol��L1�������ܶȻ�����Ksp(AgCl)=2.0��1010���ɵ���Һ��c(Ag+)=Ksp(AgCl)��c(Cl-)=2.0��1010��(1.0��105 mol��L1)=2.0��10-5 mol��L1�����ʱ��Һ��c(CrO42)=Ksp(Ag2CrO4)/c2(Ag+)=2.0��1012��(2.0��10-5 mol��L1)=5��10-3mol��L1����4�� NaHSO3���л�ԭ�ԣ�Cr2O72���������ԣ����ᷢ��������ԭ��Ӧ��������֪��������ϵ����غ㡢����غ㡢ԭ���غ㣬�ɵö��߷�Ӧ�����ӷ���ʽΪ��Cr2O72+3HSO3 +5H��=2Cr3++3SO42+4H2O��

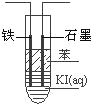
����Ŀ��I. Ϊ�Ƚ�Cl2��Fe3+��SO2�������ԣ�����ͼ��ʾװ�ý���ʵ�飬��������£�

��.���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��.����a���μ�һ������Ũ���ᣬ��A���ȡ�
��.��B�е���Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��.����b��ʹԼ2mL����Һ����D�Թ��У��������е����ӡ�
��.���ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
��.�����Թ�D���ظ����̢ܣ�����B��Һ�е����ӡ�
��1�����н������ҺΪ__________��
��2����A�������������36.5%�ܶ�Ϊ1.2g/mL����100mLʱ���䷴Ӧת�Ƶĵ�����ĿΪ______��
��3�����̢��м���B��Һ���Ƿ�����������ӵIJ�����___________��
��4���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤�������Ե���____ͬѧ����������˳��Ϊ____________��
���̢� B��Һ�к��е����� | ���̢� B��Һ �к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
II. NaNO2����Ҫ�ķ�������+3�۵ĵ�����������Ӧ�������Ի����в��ȶ�����5mol/Lˮ��ҺpHΪ9��ij��ѧ��ȤС���������ͼ��ʾװ���Ʊ��������ơ�������Ǣٹرյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ���һ��ʱ���ֹͣ���ȡ��ش��������⣺

��1��B�й۲����Ҫ������__________��Dװ�õ�������____________��
��2������C�в������������ƵIJ�����_______����Ӧ��Ӧ����ʽΪ___________��
��3��������C�в����������ƺ������١�a. ��ͬѧ��ΪC�в��ﲻ�����������ƣ������������ʡ�Ϊ�ų����ţ�����B��Cװ�ü�����װ��E��E��ʢ�ŵ��Լ���_______��д���ƣ���b. ��ͬѧ��Ϊ���������������⣬�������������뷴Ӧ���²�Ʒ������������ʵ�������ǰӦ����һ���������ò�����___��
��4���������������HNO2��Ka��ֵΪ______________��