题目内容
【题目】I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
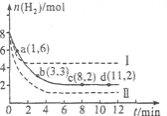
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。计算其化学平衡常数K=
(2)下列时间段平均反应速率最大的是
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)锰酸锂、钛酸锂都是绿色环保新型能源材料,可以用MnO2为原料制取锰酸锂。
①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,则阳极的电极反应式为 。
②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式为 。
【答案】(1)大于 K = 0.5L2/mol2 (2)A (3) 升温 增大压强或增大CO2 浓度
(4)①Mn2++2H2O﹣2e﹣=MnO2+4H+ ②MnO2+H2O+e﹣=MnO(OH)+OH﹣
【解析】(1)a点反应没有达到平衡,向正反应方向进行,正反应速率大于逆反应速率,根据三段式:
CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始 3mol/L 4mol/L 0 0
变化1mol/L 3mol/L 1mol/L 1mol/L
平衡 2mol/L 1mol/L 1mol/L 1mol/L
K=1×1/(2×13)=0.5L2/mol2;
(2) 反应开始时,反应物浓度最大,故开始时速率最大,选A;
(3)从图中可判断,改变实验条件后,达到平衡所用时间短,即反应速率加快人,平衡时H2的量减少,平衡正向移动,可以增大压强或增大CO2 浓度;
⑷①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,阳极发生氧化反应,在阳极产生了MnO2,根据化合价、电荷守恒、原子守恒,阳极的电极反应式为:Mn2++2H2O﹣2e﹣=MnO2+4H+;②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,锌是负极,MnO2是正极,正极的电极反应式为:MnO2+H2O+e﹣=MnO(OH)+OH﹣。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案