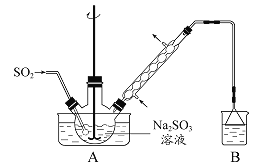
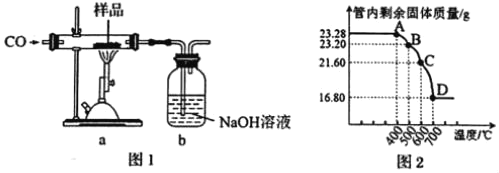
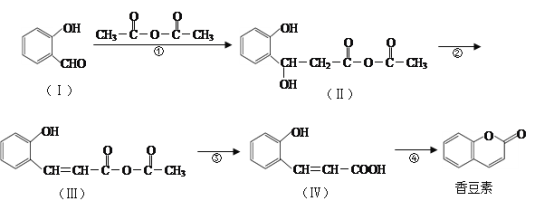
题目内容
【题目】向100mL FeBr2溶液中通入标准状况下的氯气3.36L,测得所得溶液中c(Cl-)=c(Br-),则原FeBr2溶液物质的量浓度为
A.0.75mol/LB.1.5mol/LC.2mol/LD.3mol/L
【答案】C
【解析】
还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再反应反应2Br-+Cl2═Br2+2Cl-,溶液中含有Br-,说明氯气完全反应,据此分析计算。
还原性Fe2+>Br-,所以通入氯气后,先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为![]() =0.15mol,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应;设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得:x=0.2mol,所以原FeBr2溶液的物质的量浓度为
=0.15mol,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应;设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得:x=0.2mol,所以原FeBr2溶液的物质的量浓度为![]() =2mol/L,故选C。
=2mol/L,故选C。

【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。