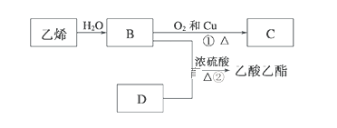
题目内容
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。
【答案】Ar ![]() O=C=O
O=C=O ![]() HClO4 C+4HNO3(浓)
HClO4 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
CO2↑+4NO2↑+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
由表中元素所在的位置,可确定①为氢(H),②为碳(C),③为氮(N),④为氧(O),⑤为钠(Na),⑥为铝(Al),⑦为硫(S),⑧氯(Cl),⑨为氩(Ar)。
(1) 稀有气体的原子最外层电子已经达到稳定结构,化学性质比较稳定,所以单质的化学性质最不活泼的是Ar;
(2)③为氮元素,其气态氢化物的化学式为NH3,电子式为![]() ;②与④形成的气态化合物为CO2,碳原子最外层四个电子,要形成四对共用电子对达到稳定结构,所以每个碳氧之间形成两对电子,故结构式为O=C=O;
;②与④形成的气态化合物为CO2,碳原子最外层四个电子,要形成四对共用电子对达到稳定结构,所以每个碳氧之间形成两对电子,故结构式为O=C=O;
(3)同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强;同主族元素从上到下金属性逐渐增强,非金属性逐渐减弱,所以这些元素中金属性最强的是钠,非金属性最强的是氯。金属性越强,最高价氧化物的水化物碱性越强,所以碱性最强化合物是NaOH,电子式为![]() ;非金属性越强,最高价氧化物的水化物酸性越强,所以酸性最强的含氧酸为HClO4;
;非金属性越强,最高价氧化物的水化物酸性越强,所以酸性最强的含氧酸为HClO4;
(4) ②的单质为碳,和③的最高价氧化物的水化物硝酸反应,生成二氧化碳、二氧化氮和水,根据电子守恒和原子个数守恒进行配平,则化学方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(5)⑥的单质是铝,⑤的最高价氧化物对应的水化物是NaOH,二者反应生成NaAlO2和H2,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。

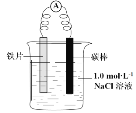
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀。
①实验i中的现象是____。
②用化学用语解释实验i中的现象:____。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是 __________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a.以上实验表明:在____条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是____________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是 _________。