��Ŀ����
����Ŀ��B�� [ʵ�黯ѧ]
���������Ƽ�ȩ(NaHSO2��HCHO��2H2O)��ӡȾ��ҽҩ�Լ�ԭ���ܹ�ҵ��Ӧ�ù㷺����Na2SO3��SO2��HCHO ��п��Ϊԭ���Ʊ����������Ƽ�ȩ��ʵ�鲽�����£�
����1������ƿ��(װ����ͼ ��ʾ) ����һ����Na2SO3��ˮ�������ܽ⣬����ͨ��SO2������ҺpH ԼΪ4���Ƶ�NaHSO3��Һ������2����װ��A �е����ܻ�����Ƥ��������ƿ�м����Թ�����п�ۺ�һ������ȩ��Һ����80 ~ 90���£���ӦԼ3h����ȴ�����£����ˡ�����3������Һ�������Ũ������ȴ�ᾧ��
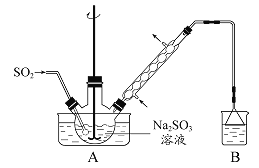
(1)װ��B ���ձ���Ӧ�������Һ�� ��
(2)������2 �У���Ӧ���ɵ�Zn(OH)2�Ḳ����п�۱�����ֹ��Ӧ���У���ֹ���������Ĵ�ʩ��
�����������л�������Ҫ���ʳ�H2O ��� (�ѧʽ)��
(3)������װ������������������ѹϵͳ��� �� (����������)������������Ҫ�ɷ��� �� (�ѧʽ)��
(4)���������Ƽ�ȩ����ǿ��ԭ�ԣ�����120�����Ϸ����ֽ⡣����3 �в��ڳ�������������Ũ����ԭ���� ��
���𰸡�
��������
��1��װ��B��������ʣ���SO2β����Ӧ����NaOH��Һ���ա���2������ֹZn(OH)2������п�۵ı�����ÿ��ٽ���ķ���������Ӧ���еļ�ȩ�е�ϵͣ����лӷ��ԣ���������������ȴ����3������װ�û���������©��������ƿ�������к������ɵ�Zn(OH)2�Լ�����δ��Ӧ��п����4��������֪�����������Ƽ�ȩ����ǿ��ԭ�ԣ����������Ŀ���Ƿ�ֹ�䱻�����е�����������

����Ŀ���״���һ�����͵���������ȼ�ϡ���ش��������⣺
(1)��ҵ�Ͽ�ͨ��CO��H2�������Ʊ�CH3OH(g)����֪ijЩ��ѧ���ļ����������±���
��ѧ�� | C-C | C-H | H-H | C-O |
| H-O |
����/kJmol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
��֪��CO�е�C��O֮���γɵĻ�ѧ��Ϊ![]() ������ҵ�Ʊ��״����Ȼ�ѧ����ʽ__________________��
������ҵ�Ʊ��״����Ȼ�ѧ����ʽ__________________��
(2)���ݻ��̶�Ϊ2L���ܱ������ڳ���1molCO��2molH2��������ʵĴ���(������Ժ��Բ���)����250���¿�ʼ��Ӧ������ѹ���Ƽ��������ѹǿ�ı仯���£�
��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
ѹǿ/MPa | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
��ӷ�Ӧ��ʼ��20minʱ����CO��ʾ��ƽ����Ӧ����Ϊ___________�����¶���ƽ�ⳣ��K= ______���������¶ȣ���CO��ת����_______(��������������С������������)��
(3)�������ݻ���Ϊ1 L�ĺ����ܱ�������ֻ������Ӧ��2CH3OH(g) ![]() C2H4(g)+2H2O(g)�����ݱ��е�������ݿ�ȷ���÷�Ӧ����H______0(������������������=������ͬ)������C�ﵽƽ��ʱ����������ѹǿp(C)/p(A)_______2������A�ﵽƽ��ʱ�����������ٳ���CH3OH(g)��C2H4(g)��H2O(g)��0.1 mol����ʱ����(��)_______��(��)��
C2H4(g)+2H2O(g)�����ݱ��е�������ݿ�ȷ���÷�Ӧ����H______0(������������������=������ͬ)������C�ﵽƽ��ʱ����������ѹǿp(C)/p(A)_______2������A�ﵽƽ��ʱ�����������ٳ���CH3OH(g)��C2H4(g)��H2O(g)��0.1 mol����ʱ����(��)_______��(��)��
���� | �¶�/�� | ��ʼ������/mol | ƽ��ʱ��ϩ/mol | ||
CH3OH(g) | C2H4(g) | H2O(g) | |||
A | 310 | 0.2 | 0 | 0 | 0.05 |
B | 327 | 0 | 0.1 | 0.2 | 0.047 |
C | 310 | 0.2 | 0.1 | 0.2 | / |