题目内容
【题目】下列离子方程式中,正确的是
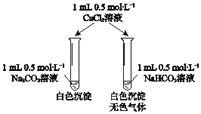
A.侯氏制碱法:NH3+CO2+H2O=![]() +
+ ![]()
B.小苏打溶液与稀硫酸混合:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3: ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
【答案】C
【解析】
A.侯氏制碱法是氯化钠、氨气、二氧化碳、水反应生成碳酸氢钠沉淀和氯化铵,反应的离子方程式是:Na++NH3+CO2+H2O=![]() ↓+
↓+![]() ,故A错误;
,故A错误;
B.小苏打是碳酸氢钠,碳酸氢钠溶液与稀硫酸混合生成硫酸钠、二氧化碳、水,反应的离子方程式是![]() +H+=CO2↑+H2O,故B错误;
+H+=CO2↑+H2O,故B错误;
C.向Ba(OH)2溶液中加少量NaHCO3生成碳酸钡沉淀、氢氧化钠、水,反应的离子方程式是![]() +Ba2++OH-=BaCO3↓+H2O,故C正确;
+Ba2++OH-=BaCO3↓+H2O,故C正确;
D.硫酸亚铁溶液与过氧化氢溶液混合生成硫酸铁,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,故D错误;
选C。

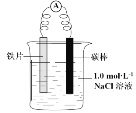
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀。
①实验i中的现象是____。
②用化学用语解释实验i中的现象:____。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是 __________。
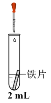
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a.以上实验表明:在____条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是____________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是 _________。
【题目】甲醇是一种新型的汽车动力燃料。请回答下列问题:
(1)工业上可通过CO和H2化合来制备CH3OH(g)。已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O |
| H-O |
键能/kJmol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知:CO中的C与O之间形成的化学键为![]() 键。工业制备甲醇的热化学方程式__________________;
键。工业制备甲醇的热化学方程式__________________;
(2)在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适的催化剂(体积可以忽略不计)后,在250℃下开始反应,并用压力计检测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到20min时,以CO表示的平均反应速率为___________,该温度下平衡常数K= ______;若升高温度,则CO的转化率_______(填“增大”“减小”或“不变”);
(3)在三个容积均为1 L的恒容密闭容器中只发生反应:2CH3OH(g) ![]() C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
容器 | 温度/℃ | 起始加入量/mol | 平衡时乙烯/mol | ||
CH3OH(g) | C2H4(g) | H2O(g) | |||
A | 310 | 0.2 | 0 | 0 | 0.05 |
B | 327 | 0 | 0.1 | 0.2 | 0.047 |
C | 310 | 0.2 | 0.1 | 0.2 | / |
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。
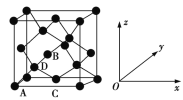
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。