题目内容
【题目】常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是
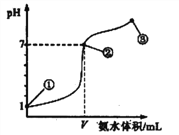
A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
【答案】D
【解析】A、NH3·H2O属于弱碱,HCl属于强酸,②点pH=7溶液显中性,NH3·H2O的物质的量略大于盐酸物质的量,即V略大于20mL,故A错误;B、根据电荷守恒,因此有c(H+)=c(Cl-)+c(OH-),故B错误;C、②点pH=7,因此是c(H+)=c(OH-),故C错误;D、②和③之间溶质为NH3·H2O和NH4Cl,因此可能存在c(NH4+)>c(Cl-)=c(OH-)>c(H+),故D正确。

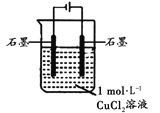
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
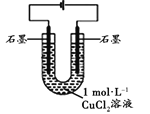
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。