题目内容
【题目】原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________。
(2)下列反应能设计成原电池的是: 。
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
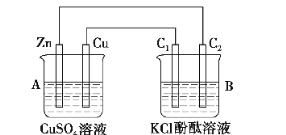
(4)下图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。
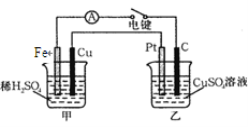
【答案】(1)甲(原电池)
(2)① (3) 2Fe3++Cu=Cu2++2Fe2+
(4)2H2O4e=O2↑+4H+ 6.4
【解析】(1)原电池是将化学能转化成电能装置,电解池是将电能转化成化学能的装置。
(2)原电池原理是氧化还原反应,①属于氧化还原反应,能构成原电池,故正确;②③不是氧化还原反应,不能构成原电池,故错误。
(3)Fe3+具有强氧化性,能与Cu反应,Cu+2Fe3+=2Fe2++Cu2+。
(4)甲为原电池装置,乙为电解池装置,Pt连接原电池的阳极,根据电解原理,反应式为2H2O4e=O2↑+4H+,甲中正极反应式:2H++2e=H2↑,乙装置C极反应式,Cu2++2e=Cu,得失电子数目守恒,因此产生Cu的质量为0.1×64 g=6.4 g。

练习册系列答案
相关题目