��Ŀ����
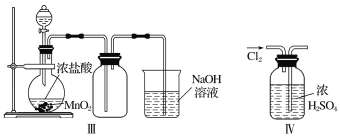
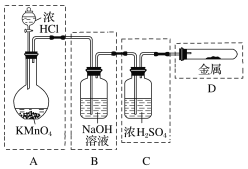
����Ŀ���Ʊ�пӡˢ��·������ϡ���ḯʴп���������ķ�Һ�ơ��ð�Һ�������ð�Һ���г�������п��������������ˮ�����Cl��Fe3+����ʵ���������á��ð�Һ����ȡZnSO4��7H2O�Ĺ�����ͼ��ʾ��
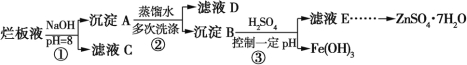
��1����ϡ���ḯʴп��ʱ��ԭ����ΪN2O���������뻹ԭ�������ʵ���֮���� ��
��2������������pH>12����Zn(OH)2�ܽ�����ƫп���ơ�Zn(OH)2�ܽ�����ӷ���ʽΪ ��
��3����ҺD�г��˺���OH���������е��������� (�����ӷ���)��
��4������ҺE��pH=4��c(Zn2+)=2 mol��L1��c(Fe3+)=2.6��109mol��L1������õ��ܶȻ��� ��
A��Ksp [Zn(OH)2] B��Ksp [Zn(OH)2]��Ksp [Fe(OH)3] C��Ksp [Fe(OH)3]
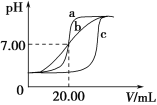
��5��������Ҫ����pH��һ����Χ��ʵ������pH��ֽ�ⶨ��ҺpH�ķ����� ��
��6����֪����Fe(OH)3(s)![]() Fe3+(aq)+3OH(aq) ��H=a kJ��mol1
Fe3+(aq)+3OH(aq) ��H=a kJ��mol1
��H2O(l)![]() H+(aq)+OH(aq) ��H=b kJ��mol1
H+(aq)+OH(aq) ��H=b kJ��mol1
�������ܶȻ�����ΪKsp���������ӻ�����ΪKw��Fe3+����ˮ�ⷴӦ��ƽ�ⳣ����K= (�ú�Ksp��Kw�Ĵ���ʽ��ʾ)��
���𰸡���1��1��2
��2��Zn(OH)2+2OH![]() Zn
Zn![]() +2H2O
+2H2O
��3��Cl��![]() ��4��C
��4��C
��5����pH��ֽ���ڲ���Ƭ�����ò�������ȡ����Һ������ֽ�м���Ȼ�������ɫ���Ա�����������
��6��![]()
����������1��4Zn+10HNO3![]() 4Zn(NO3)2+N2O��+5H2O��HNO3������������10 mol HNO3�з������ϼ۸ı��ֻ��2 mol��Zn����ԭ���������������뻹ԭ�������ʵ���֮����1��2��
4Zn(NO3)2+N2O��+5H2O��HNO3������������10 mol HNO3�з������ϼ۸ı��ֻ��2 mol��Zn����ԭ���������������뻹ԭ�������ʵ���֮����1��2��
��4����ҺE��pH=4ʱ��Zn(OH)2�Ѿ��ܽ�������������ܶȻ�����Fe(OH)3�Գ�����ʽ���������Կ�����á�
��6��������3�����ɵõ�Fe3+(aq)+3H2O(l)![]() Fe(OH)3(s)+3H+(aq) ��H=(3ba) kJ��mol1
Fe(OH)3(s)+3H+(aq) ��H=(3ba) kJ��mol1
Ksp[Fe(OH)3]=c(Fe3+) ��c3(OH)��Kw=c(OH) ��c(H+)��Fe3+ ����ˮ�ⷴӦ��ƽ�ⳣ��K=![]() =
=
![]() =
=![]() ��
��

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�