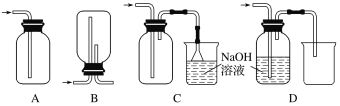
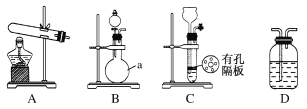
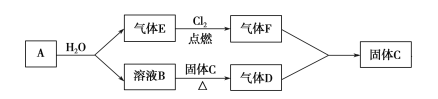
题目内容
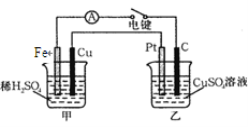
【题目】按下图所示装置进行实验,并回答下列问题:
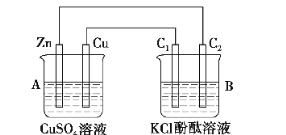
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为__________极,电极反应式为____________________________________________;
铜极为__________极,电极反应式为_____________________________________________;
石墨棒C1为__极,电极反应式为________;石墨棒C2附近发生的实验现象为
________________________________________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)________g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
【答案】(1)原电池 电解池
(2)负 Zn2e===Zn2+ 正 Cu2++2e===Cu
阳 2Cl2e===Cl2↑ 有无色气体产生,附近溶液出现红色
(3)减少 0.65 增加 0.01
【解析】(1)A池中Zn、Cu放入CuSO4溶液中构成原电池,B池中两个电极均为石墨电极,在以A为电源的情况下构成电解池,即A原电池带动B电解池。
(2)A池中Zn为负极,Cu为正极,B池中C1为阳极,C2为阴极,阴极区析出H2,周围OH富集,酚酞变红。
(3)n(H2)=0.224 L÷22.4 L·mol1=0.01 mol,故电路中转移电子的物质的量为0.01 mol×2=0.02 mol,根据得失电子守恒,锌极有0.01 mol Zn溶解,即Zn极质量减少0.01 mol×65 g·mol1=0.65 g,铜极上有0.01 mol Cu析出,即CuSO4溶液增加了0.01 mol×(65 g·mol164 g·mol1)=0.01 g。