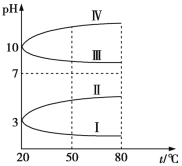
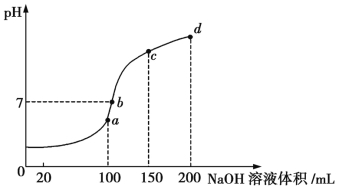
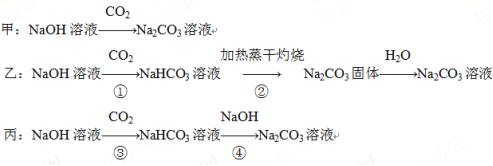
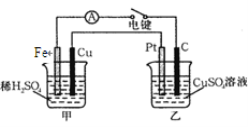
题目内容
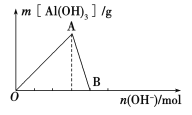
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
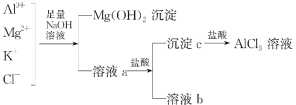
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_______________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)溶液a中存在的离子有________________;在溶液a中加入盐酸时需控制盐酸的量,为什么?__________________________________。为此,改进方法是___________________________。
【答案】(1)Mg2++2OH===Mg(OH)2↓、Al3++3OH===Al(OH)3↓、Al(OH)3+OH===![]() +2H2O
+2H2O
(2)不能,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(3)Na+、![]() 、K+、Cl、H+、OH 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀
、K+、Cl、H+、OH 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀![]() 时,需要控制溶液的pH,以防止部分
时,需要控制溶液的pH,以防止部分![]() 转化成Al3+ 通入过量CO2气体
转化成Al3+ 通入过量CO2气体
【解析】解答本题的关键是明确Mg2+、Al3+均能与NaOH溶液反应生成沉淀,而Mg(OH)2不能继续溶解,Al(OH)3能溶解在过量的NaOH溶液中。不能用氨水代替NaOH溶液,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目