题目内容
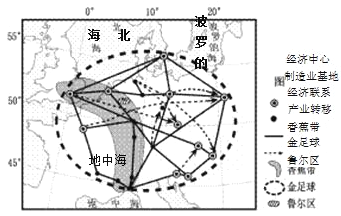
【题目】下图是二战前后钢铁工业区区位因素的转变示意图,图中圆圈大小表示影响钢铁厂区位因素的强弱。读图,回答下列下列各题。

【1】图中X、Y依次为
A.燃料、市场 B.燃料、环境
C.劳动力、市场 D.交通、环境
【2】二战后至今,下列地域中发展钢铁工业优势与右图相符的是
A.美国“硅谷” B.德国鲁尔区
C.日本太平洋沿岸 D.中国辽中南
【答案】
【1】A
【2】C
【解析】
试题分析:
【1】二战前,钢铁工业生产技术水平低,单位钢产品需要消耗的煤、铁矿石多,工业布局要靠近原料、燃料产地,原料、燃料是主导区位因素。X是燃料。二战后,工业技术发展,工业区位选择受原料、燃料 的影响减小,工业布局靠近市场,市场成为主导区位因素。Y是市场。A对。环境、劳动力是重要影响因素,不是主导因素,B、C、D错。
【2】读右图,结合前面分析,图中钢铁工业的优势区位因素是科技和市场。日本煤、铁资源缺乏,钢铁工业分布在太平洋沿岸的主要原因是科技、市场,C对。美国“硅谷”、德国鲁尔区、中国辽中南都不是市场指向型产业,A、B、D错。

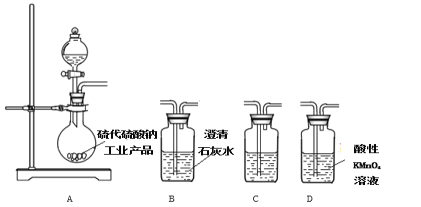
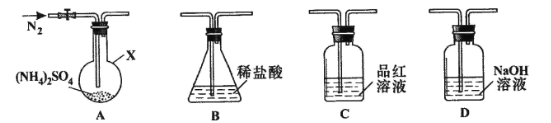
【题目】甲乙两同学分別对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置己略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4
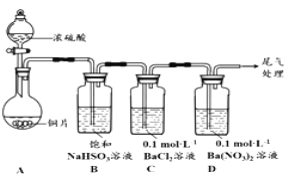
①A中反应的化学方程式是______________________。
②为探究SO2在D中所发生反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价硫元素的物质性质进行探究。
序号 | 实验操作 | 实验现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大重白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:____________________。
②由实验1、2、3对比,可以得到推论:____________________。
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取_______固体混合物,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii实验1和4对比,乙获得推论:_____________________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加_________(填字母序号)
a. 2mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b. 2mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c. 2mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d. 2mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀