题目内容
【题目】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
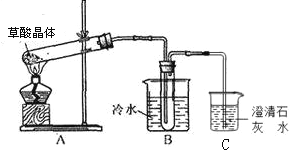
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
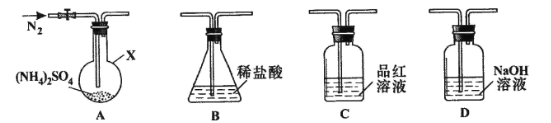
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液 b.用0.2000mol/L NaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在400℃分解的化学方程式是______________________.
【答案】
(1)圆底烧瓶
(2)dbaec
(3)0.03 mol
(4)取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体
(5)NH3
(6)3(NH4)2SO4![]() 4NH3↑+ N2↑+3SO2↑ + 6H2O↑
4NH3↑+ N2↑+3SO2↑ + 6H2O↑
【解析】(1)仪器X为圆底烧瓶。
(2)滴定操作步骤为:首先查漏、水洗,再用待装的溶液润洗,再装液,再排尽滴定管尖嘴的气泡并调整液面,最后记录读数。
(3)由题意知:品红溶液不褪色,说明无SO2,滴定后的溶液中无SO42-,说明无SO3则装置B中吸收的气体为NH3。n(HCl)= n(NH3) +n(NaOH),则得答案为0.03 mol
(4)取装置D内溶液少许于试管中,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀且加入盐酸后白色沉淀能完全溶液,则说明原溶液中有SO32-,无SO42-
(5)NH3
(6)3(NH4)2SO4![]() 4NH3↑+ N2↑+3SO2↑ + 6H2O
4NH3↑+ N2↑+3SO2↑ + 6H2O

 阅读快车系列答案
阅读快车系列答案