题目内容
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() ) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
) (填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)= (填数值)。
)-3c(Al3+)= (填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
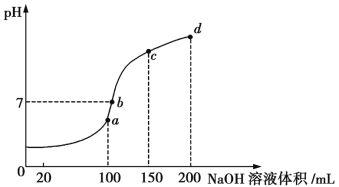
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
【答案】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水
(2)小于
(3)①Ⅰ NH4Al(SO4)2溶液呈酸性,升高温度其水解程度增大,pH减小 ②10-3 mol/L
(4)a点 c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
【解析】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3吸附水中的悬浮颗粒使其沉降。
Al(OH)3(胶体)+3H+,Al(OH)3吸附水中的悬浮颗粒使其沉降。
(2)NH4Al(SO4)2溶液与NH4HSO4溶液中的![]() 均发生水解,但NH4Al(SO4)2溶液中Al3+水解后溶液呈酸性抑制
均发生水解,但NH4Al(SO4)2溶液中Al3+水解后溶液呈酸性抑制![]() 的水解,NH4HSO4溶液中
的水解,NH4HSO4溶液中![]() 电离出的H+同样抑制
电离出的H+同样抑制![]() 的水解,相同条件下,因为
的水解,相同条件下,因为![]() 电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4溶液中
电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4溶液中![]() 的水解程度比NH4Al(SO4)2溶液中
的水解程度比NH4Al(SO4)2溶液中![]() 的小。
的小。
(3)NH4Al(SO4)2溶液呈酸性,升高温度其水解程度增大,pH减小,符合其变化的曲线为Ⅰ。根据电荷守恒,可以得出2c(![]() )-c(
)-c(![]() )-3c(Al3+)=c(H+)-c(OH-)=10-3 mol/L[其中c(OH-)太小,可忽略]。
)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol/L[其中c(OH-)太小,可忽略]。
(4)分析a、b、c、d四个点,根据反应物的用量可知,a点恰好消耗完![]() 电离出来的H+,溶液中的溶质为(NH4)2SO4与Na2SO4;b、c、d三点溶液中均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,故a点水的电离程度最大。b点溶液呈中性,即溶液中含有(NH4)2SO4、Na2SO4、NH3·H2O三种溶质,a点时c(Na+)=c(
电离出来的H+,溶液中的溶质为(NH4)2SO4与Na2SO4;b、c、d三点溶液中均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,故a点水的电离程度最大。b点溶液呈中性,即溶液中含有(NH4)2SO4、Na2SO4、NH3·H2O三种溶质,a点时c(Na+)=c(![]() ),则b点时c(Na+)>c
),则b点时c(Na+)>c![]() ),根据电荷守恒可得b点时c(
),根据电荷守恒可得b点时c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() ),故可以得出c(
),故可以得出c(![]() )>c(
)>c(![]() ),故b点时c(Na+)>c
),故b点时c(Na+)>c![]() )>c(
)>c(![]() )>c(OH-)=c(H+)。
)>c(OH-)=c(H+)。

 习题精选系列答案
习题精选系列答案