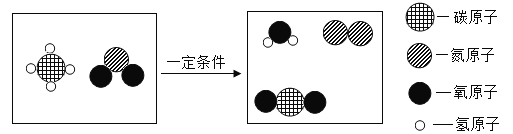
【题目】钢铁的腐蚀是重要研究课题。
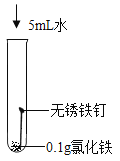
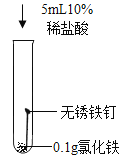
(知识回顾)用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
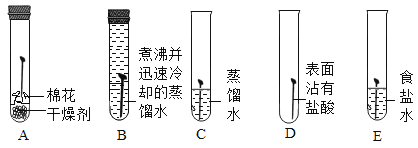
(1)由A、B、C的现象可知,铁的锈蚀是铁跟________________(填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是________________。
(实验探究)向试管D中(含生锈铁钉)加人过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式:________________。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如下3个实验(持续10小时,已知氢气不影响该反应)。
序号 | 实验I | 实验Ⅱ | 实验Ⅲ |
实验内容 |
|
|
|
现象 | 溶液颜色始终呈黄色 | 产生红褐色沉淀 | 溶液逐渐由黄色变浅绿色 |
①设计实验I的目的是________________。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是__________。
(拓展延仲)研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。
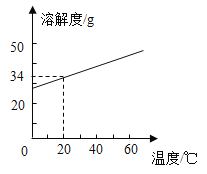
(5)如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是___________________。

(6)如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是________________。

【题目】碳酸钠俗称纯碱或苏打,在生活、生产和实验硏究中均有广泛应用。
(配制溶液)配制溶质质量分数分別为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是______(填字母)。
a.用托盘天平称取2gNa2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ |
溶质质量分数 | 1% | 2% | 4% |
溶液pH | 11.62 | 11.76 | 11.90 |
分析I、Ⅱ、Ⅲ三组数据可得出的结论是________。
(制备物质)用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
(已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀)
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是______(填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:![]() ,则X的化学式为___________。
,则X的化学式为___________。
(标定浓度)标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g·mL-1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数_____(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将_____(填“偏大”、“偏小”或“无影响”)。