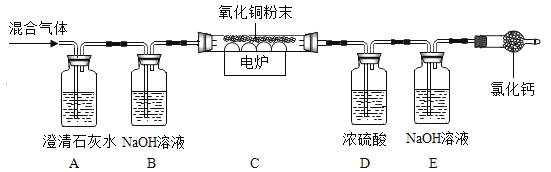
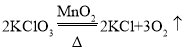题目内容
【题目】碳酸钠俗称纯碱或苏打,在生活、生产和实验硏究中均有广泛应用。
(配制溶液)配制溶质质量分数分別为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是______(填字母)。
a.用托盘天平称取2gNa2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ |
溶质质量分数 | 1% | 2% | 4% |
溶液pH | 11.62 | 11.76 | 11.90 |
分析I、Ⅱ、Ⅲ三组数据可得出的结论是________。
(制备物质)用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
(已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀)
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是______(填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:![]() ,则X的化学式为___________。
,则X的化学式为___________。
(标定浓度)标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g·mL-1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数_____(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将_____(填“偏大”、“偏小”或“无影响”)。
【答案】ab 25℃时,Na2CO3溶液的溶质质量分数越大,碱性越强 b Fe(OH)3 0.73% 偏大
【解析】
(1)配制50g、4%的碳酸钠溶液,需要称量碳酸钠的质量为:50g×4%=2g,需要称量水的体积为:50g-2g=48g,48g÷1g/mL=48mL。
a、根据分析可知,应该用托盘天平称量碳酸钠固体2g。a正确;
b、通过分析可知,需要量取48mL的水,则需要50mL的量筒。b正确;
c、碳酸钠溶液是液体,应该使用细口瓶盛装,并且用贴上标签。c错误。
故答案为:ab;
(2)通过图表可知,25℃时,碳酸钠溶液的溶质质量分数越大,溶液的pH越大,则溶液的碱性越强。故答案为:25℃时,Na2CO3溶液的溶质质量分数越大,碱性越强;
(3)根据提示信息可知,当溶液的pH>8.8时,Fe2+会完全生成Fe(OH)2沉淀。而该反应的目的是制备FeCO3沉淀,碳酸钠的水溶液呈碱性,则可能会产生副产物Fe(OH)2沉淀。如果将FeSO4加入Na2CO3溶液中,则碳酸钠溶液呈碱性,存在OH-,pH>7,很容易生成Fe(OH)2沉淀。若将Na2CO3溶液加入FeSO4溶液中,此时Fe2+是过量的,而且此时溶液显酸性,Fe2+不易产生Fe(OH)2沉淀,此时CO32-很容易和Fe2+结合为沉淀析出。故答案为:b;
(4)根据质量守恒定律可知,反应前后原子的个数相同。则反应前,有4个铁原子、4个碳原子、12个氢原子、20个氧原子,反应后有4个碳原子、8个氧原子,相差了4个铁原子、12个氢原子、12个氧原子,则X的化学式为Fe(OH)3。故答案为:Fe(OH)3;
(5)①消耗盐酸的质量为:20mL×1g·mL-1=20g。
设反应消耗的HCl的质量为x。
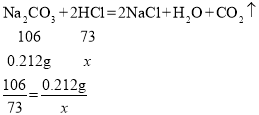
解得x=0.146g
则盐酸的溶质质量分数为:![]() 。
。
②若碳酸钠没有充分干燥,则实际的碳酸钠的质量小于0.212g,则消耗的HCl的质量小于对应的0.146g,对应消耗的盐酸溶液的质量也小于20g。但是进行相关计算时,仍然会按照“碳酸钠的质量为0.212g”进行计算,则会导致计算溶质的质量分数时,计算的参加反应的HCl的质量依然为0.146g,但是实际消耗的溶液的质量减少了,则会导致计算出的溶质质量分数偏大。故答案为:偏大。