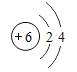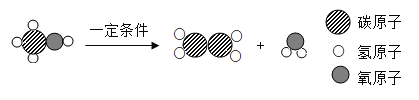【题目】实验室中氯酸钾样品含有杂质,为了测定样品中氯酸钾的质量分数,取 10g 该样品与 1g 二氧化锰混合加热 t1 时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热 t2、t3、t4 时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 10.04 | 9.08 | 8.12 | 8.12 |
(1)请问完全反应后产生氧气的质量为_____g 。
(2)求该样品中氯酸钾的质量分数_____(要求写出计算过程)。反应的化学方程式为:2KClO3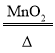 2KCl+ 3O2↑
2KCl+ 3O2↑
【题目】每年的 CES(国际消费类电子产品展览会)都会有一大波“黑科技”产品发布, 而这些产品大多是由金属材料制成,铜是其中重要的金属材料。
I.自然界中的铜主要以化合物形式存在于铜矿石中,从“绿色化学”的理念分析,以下铜矿最适宜炼铜的是_____(填序号)
A 黄铜矿(CuFeS2) B 辉铜矿(Cu2S)
C 蓝铜矿 [Cu(OH)2(CO3)2 ] D 斑铜矿(Cu5FeS4)
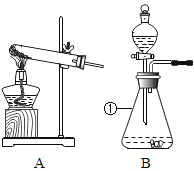
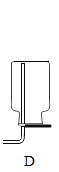
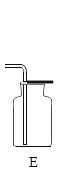
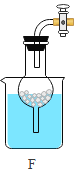
II.某化学兴趣小组用如下实验装置制取一氧化碳,再用一氧化碳还原氧化铜模拟炼铜。
(查阅资料)
(1)实验室常用甲酸(H2CO2)和浓硫酸混合加热制备 CO,同时生成 H2O。
(2)浓硫酸具有吸水性。
(进行实验)小组同学组装好下图装置并检查装置气密性之后开始实验,先让 A 装置反应一会儿,然后熄灭 A 中的酒精灯,再点燃 C 装置中的酒精灯。
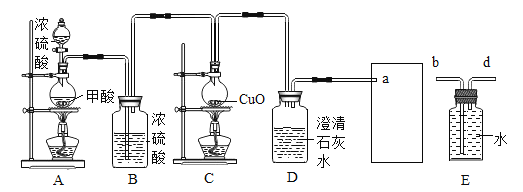
(1)装置 B 的作用是_____;装置 C 中发生反应的化学方程式是_____。
(2)装置 D 的作用是_____;该装置的组装存在的错误是_____; 改正之后,该装置中发生反应的化学方程式是_____。
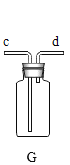
(3)为避免一氧化碳污染空气,回收利用一氧化碳,方框中应连接装置 E,与 a 导管接口相接的是_____(填“b”或“d”)。
(4)实验结束之后,得到带有金属光泽的砖红色粉末,小组决定对该固体的成分进行探究。
(提出问题)红色的固体是什么?
(查阅资料)氧化亚铜(Cu2O)是红色粉末状固体;
会与稀硫酸反应:Cu2O + H2SO4 == CuSO4 + Cu + H2O。
(提出猜想)猜想一:该固体全部为 Cu;
猜想二:该固体全部为 Cu2O;
猜想三:该固体为 Cu2O 和 Cu 的混合物。
(实验方案)
实验步骤 | 实验现象及实验结论 |
取少量固体粉末于试管中, 加入过量_____溶液。 | 若无明显变化,则猜想一成立; 若溶液变为_____色,则猜想二或猜想三成立。 |
为了进一步确定混合物的组成,另取 m g 固体,重复上述实验,然后将反应后的物质过滤、洗涤、干燥,再次称量得到 n g 固体,若 m 和 n 满足_____的量的关系,则 猜想三成立。
(得出结论)该固体为 Cu2O 和 Cu 的混合物。
(交流讨论)
(1)从实验安全的角度考虑,本实验存在的危险是_____,改进的方法是_____;
(2)从物质的转化程度考虑,小组同学针对如何将氧化铜全部转化为铜单质展开讨论, 查阅了大量资料之后知道,反应条件是影响生成物的重要因素,因此一致认为在下次实验中需要适当加大 CO 的通入量或者_____。