题目内容
【题目】实验室中氯酸钾样品含有杂质,为了测定样品中氯酸钾的质量分数,取 10g 该样品与 1g 二氧化锰混合加热 t1 时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热 t2、t3、t4 时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 10.04 | 9.08 | 8.12 | 8.12 |
(1)请问完全反应后产生氧气的质量为_____g 。
(2)求该样品中氯酸钾的质量分数_____(要求写出计算过程)。反应的化学方程式为:2KClO3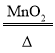 2KCl+ 3O2↑
2KCl+ 3O2↑
【答案】2.88 73.5%
【解析】
(1)根据质量守恒定律可知,反应前后相差的质量为生成的氧气的质量。并且二氧化锰是催化剂,在化学反应前后质量不变,则生成氧气的质量为:10g+1g-8.12g=2.88g。故答案为:2.88;
(2)设参加氯酸钾的质量为x。
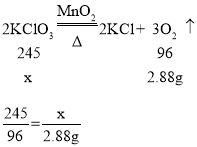
解得x=7.35g
所以,该样品的氯酸钾的质量分数为:![]() 。
。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目