【题目】高铁的开通对丹东的发展起到极大的推动作用。高铁建设需要大量的钢铁材料.
(1)工业炼铁的原理方程式是_________(以赤铁矿为例)
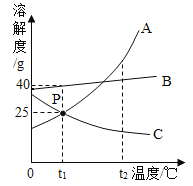
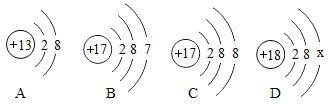
(2)锰钢是一种合金,可用于高铁建设。已知金属活动性:锰>铁.锰的部分化合物溶解性见右表。若用实验验证铁、铜、锰三种金属的活动性,至少需要的三种试剂是_________
OH- | NO3- | Cl - | SO42- | CO32- | |
Mn2+ | 不 | 溶 | 溶 | 溶 | 不 |
(3)已知铁的硬度为5,锰的硬度为6,锰钢的硬度__(填“>6”、“<5”或“介于5-6之间”).
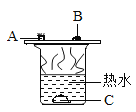
【题目】某化学兴趣小组进行以下实验:在室温为 15℃时,同学们将 10g 氢氧化钠固体完全溶解于 80g 水中,冷却至室温后匀速的通入二氧化碳气体。同时用传感器测定溶液的 pH 及温度的变化,用数据采集器记录并绘制图像如图 2 和图 3 所示。
(查阅资料)
①碳酸氢钠和碳酸钠的溶解度表(一个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 |
碳酸氢钠的溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
碳酸钠的溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
②向碳酸钠溶液中通入二氧化碳能化合生成碳酸氢钠。
(进行实验)

(1)图 1 所示实验中,用“分液漏斗”而不用“长颈漏斗”的原因是_____;
(2)通过图像分析,小苏打溶液是显_____(填“酸性”、“中性”或“碱性”)。
(3)为了确定M 处溶液的成分,同学们进行了如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 加入过量的_____; | 产生白色沉淀 | 含有_____。 |
② | 滴入_____; | 溶液变红 |
(反思与评价)
(4)为确定 M 处溶液的成分,(3)中步骤①中加过量试剂的目的是_____,步骤①②能否颠倒?_____(填“能”或“否”)。/p>
(注意:若答对第(5)、(6)小题奖励 4 分,化学试卷总分不超过 60 分。)

(拓展延伸)
(5)实验过程中,同学们发现 18min 后溶液的 pH 不再变化, 则此时烧杯中就可能观察到的现象有_____。
(6)图 2 中,BC 段发生反应的化学方程式为_____。图 3 中,DE 段温度变化的原因_____。
【题目】某校化学活动小组准备测定生成O2 的体积并探究影响反应速率的因素。
(实验一)通过下列实验,利用二氧化锰粉末与过氧化氢溶液反应来测定生成 O2 的体积。
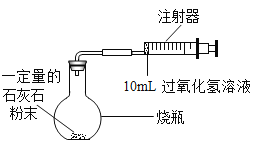
(1)实验中,先连接好装置后检查装置的气密性,然后装好药品,最后将 10mL 过氧化氢溶液_______(填“快速”或“缓慢”)推入烧瓶中,如果不这样操作,则可能造成的后果是_________。
(实验二)探究 H2O2 质量分数、溶液 pH、温度对反应速率的影响。设计如下表实验方案:
实验序号 | H2O2 质量分数 | pH | 温度/℃ | 30s 内收集到氧气的体积 |
1 | 25 | 5 | 20 | |
2 | 25 | 6 | 20 | |
3 | 25 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
(2)实验 1~3 的实验目的是_____。
(3)a=_____;b=_____。
(实验三)探究催化剂对化学反应速率的影响:
取 5mL 溶质质量分数相同的 H2O2 溶液,三次实验分别加入质量均为 0.5gMnO2、红砖粉末、CuO 进行实验,记录收集相同体积氧气所用时间的数据如下:
试剂
MnO2
红砖粉末
CuO
时间/s
10
60
20
由此得出结论:MnO2、CuO 对 H2O2 分解有催化作用,红砖粉末无催化作用。
(4)你认为该结论是否正确?_____(填“正确”或“不正确”),为什么?_____。