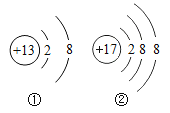
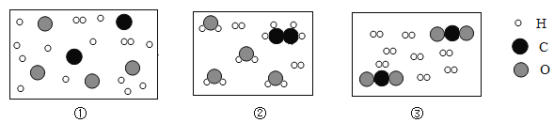
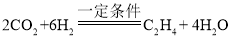题目内容
【题目】如图所示,A、B、C为三种固体的溶解度曲线
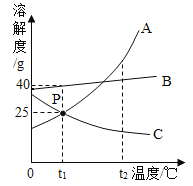
(1)当温度t为__________时,三种物质的溶解度关系是B>C>A。
(2)t1℃时,将30gA、B、C三种物质分别投入100g水中,充分溶解,所得溶液为饱和溶液的是____。
(3)将t2℃时,等质量的三种物质的饱和溶液降温到t1℃,所得溶液的质量由小到大的顺序是________。
(4)t1℃时,欲用50gA的饱和溶液配制10%的A溶液,需要加水________g。
【答案】<t1 A、C A<B<C 50
【解析】
(1)通过分析溶解度曲线可知,当温度t为<t1时,三种物质的溶解度关系是B>C>A;
(2)t1℃时,B物质的溶解度是40g,A,C物质的溶解度是25g,根据溶解度概念可知,将30gA、B、C三种物质分别投入100g水中,充分溶解,所得溶液为饱和溶液的是A、C;
(3)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,A、B的溶解度减小,C的溶解度随温度的降低而增大,A、B有晶体析出,且A的溶解度受温度影响较大,析出晶体较多,C没有晶体析出,所以t1℃时,所得溶液的质量由小到大的顺序是A<B<C;
(4)t1℃时,A溶解度为25g,饱和溶液的溶质质量分数=![]() ,设用50gA的饱和溶液配制10%的A溶液,需要加水质量为x,则有:50g×20%=(50g+x)×10%,x=50g,需要加水50g。
,设用50gA的饱和溶液配制10%的A溶液,需要加水质量为x,则有:50g×20%=(50g+x)×10%,x=50g,需要加水50g。

 作业辅导系列答案
作业辅导系列答案【题目】研究物质的溶解度对于生产、生活有着重要意义。经实验测定,获得不同温度时硝酸钾的溶解度数据。分析下列表格中的数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度是_____℃。
温度(℃) | 20 | 40 | 50 | 60 | 70 | 80 |
溶解度(g/100g 水) | 31.6 | 63.9 | 145 | 110 | 140 | 169 |
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。_____
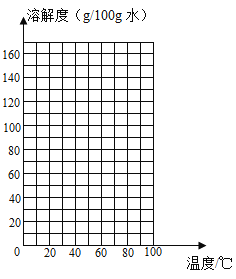
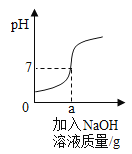
可知:硝酸钾的溶解度随温度升高而_____(选填 “增大”或“减小”); 60℃时,将60g硝酸钾固体加入50g水中,所形成的溶液为_____溶液(填写“饱和”或“不饱和”),所得溶液的溶质质量分数为_____ (精确到0.1%)。下图是有关硝酸钾溶液的实验操作及变化情况,已知溶液①到溶液②的过程中,溶液质量保持不变,
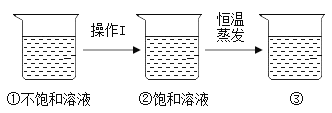
操作I的具体名称为_____,三种溶液的溶质质量分数大小关系为①_____②_____③(填“>”、“<”或“=”)。
【题目】请你根据如图回答有关问题:
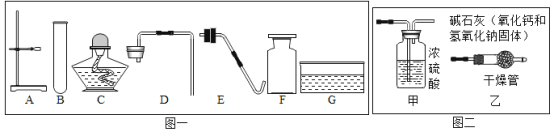
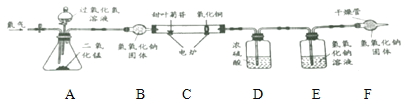
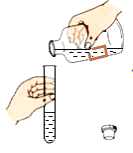
(1)实验室欲制备并收集二氧化碳,需在图一中选用A、B与___________(填序号)组合,该反应的化学方程式为_________________。
(2)图二是两套干燥气体装置,可用于干燥二氧化碳的是_______________(填“甲”或“乙”),为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
[查阅资料]
I.20°C时,几种物质在水中的溶解度见下表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
II.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
[实验探究]
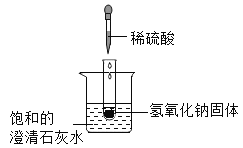
(3)实验一:小雨取一充满CO2 的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满 CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_________________。
(4)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液 X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_________________。实验中不宜将BaCl2溶液换成CaCl2溶液的原因是________________。
(5)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈_______________色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是_________________。
(6)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。
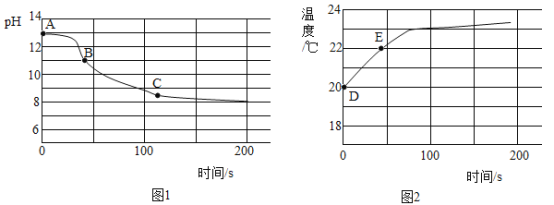
图2中,DE段温度变化的原因是________________。
[反思感悟]
(7)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及______________转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。