【题目】镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体,细心的小明同学发现,镁条燃烧除生成白色固体外,还有少量的淡黄色固体生成,经查阅资料得知:淡黄色固体是由镁条和空气中的氮气化合产生的,写出该反应的化学方程式__,产生的白色固体比淡黄色固体多的原因是__。他还发现镁条在空气中久置表面会变黑,实验小组同学设计并进行实验,探究镁条变黑的条件。
[猜想假设]常温下,镁条变黑可能与O2、CO2、水蒸气有关。
[查阅资料]常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
[设计实验]通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL) ,分别进行下列5个实验,并持续观察20天。

实验操作 | 实验现象 |
1.先充满用NaOH浓溶液洗涤过的空气,再加人2mL浓硫酸 | 镁条始终无明显变化 |
2.加人NaOH浓溶液 | 镁条始终无明显变化 |
3.先加人2mL浓硫酸,再通入约4mLCO2 | 镁条始终无明显变化 |
4.先加入4mL饱和Na2SO3溶液,再充满CO2 | 镁条始终无明显变化 |
5.先加入2mL蒸馏水,再通入约4mL CO2 | 镁条第3天开始变黑,至第20天全部变黑 |
[解释与结论]①实验1的目的是_;②实验3中,试管内气体主要含CO2和__;③得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___(填序号);④由上述实验可知,镁条变黑的条件是__。
[反思与评价]①在猜想假设时,同学们认为镁条变黑与N2无关,理由是_____;
②实验1和实验2中,NaOH浓溶液的作用是__;③欲进一步证明镁条表面的黑色物质中含有碳酸盐,你的实验方案是__。
【题目】Cl2是黄绿色气体,水溶液叫氯水,把品红试纸伸入氯水中,品红试纸褪色。
[提出问题]氯水中的哪些成分能使品红试纸褪色呢?
[查阅资料]氯气溶于水,部分与水反应,方程式为![]() 。HClO(次氯酸)是一种弱酸,具有强氧化性。
。HClO(次氯酸)是一种弱酸,具有强氧化性。
[猜想假设]猜想1:氯水中的水使品红褪色;猜想2:氯水中的Cl2使品红褪色;
猜想3:氯水中的__使品红褪色;猜想4:氯水中的HClO使品红褪色。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
1.把品红试纸伸入水中 | 没有褪色 | 猜想1__ |
2.____ | 没有褪色 | 猜想2不成立 |
3.把品红试纸伸入稀盐酸中 | _ | 猜想3不成立 |
[实验结论]综合分析判断:氯水中的__(填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。
[拓展应用]①向氯水中滴加紫色石蕊溶液,观察到的现象是___;②氯水中加人AgNO3溶液有白色沉淀生成,化学方程式为__。
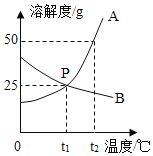
【题目】NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4C1 | 3.33 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
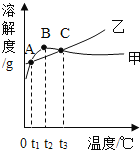
A.甲为NH4C1的溶解度曲线
B.两种物质的溶解度均随温度升高而增大
C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D.等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等