题目内容
【题目】碳酸亚铁(FeCO3)是生产补血剂的原料。以下是某同学设计的利用铁矿烧渣(主要成分是Fe2O3、FeO和泥沙等)制取FeCO3的实验流程图:
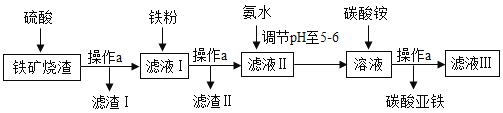
请回答下列问题:
(1)操作a中需要用到的玻璃仪器主要有烧杯、漏斗和___。
(2)滤液I中含有的金属阳离子有Fe2+和___(填离子符号),向滤液I中加入铁粉后可能发生的化学反应方程式为:①__;②![]() 。
。
(3)“调节滤液Ⅱ的pH至5--6”的操作中,若用pH试纸测定该溶液的pH,其操作步骤为_。
(4)加入碳酸铵得到碳酸亚铁的基本反应类型是___。
【答案】玻璃棒 Fe3+ ![]() 用玻璃棒蘸取该溶液滴到表面皿上的pH试纸上,再与标准比色卡对比,读出pH 复分解反应
用玻璃棒蘸取该溶液滴到表面皿上的pH试纸上,再与标准比色卡对比,读出pH 复分解反应
【解析】
铁矿烧渣主要成分是Fe2O3、FeO和泥沙等,向铁矿烧渣中加入硫酸,Fe2O3和硫酸反应硫酸铁和水,FeO和硫酸反应硫酸亚铁和水,泥沙和硫酸不反应,过滤之后,滤液I中有硫酸、硫酸铁和硫酸亚铁,再加入铁粉,硫酸和铁粉反应生成硫酸亚铁和氢气,硫酸铁和铁粉反应生成硫酸亚铁,过滤,得到滤液II硫酸亚铁溶液,调节pH至5-6,再加入碳酸铵,硫酸亚铁和碳酸铵反应生成碳酸亚铁和硫酸铵,过滤即可得到碳酸亚铁。
(1)操作a是过滤,用到的玻璃仪器主要有烧杯、漏斗和玻璃棒;
(2)根据分析可知,滤液I中有硫酸、硫酸铁和硫酸亚铁,所以含有的金属阳离子有Fe2+和Fe3+,向滤液I中加入铁粉,硫酸和铁粉反应生成硫酸亚铁和氢气,硫酸铁和铁粉反应生成硫酸亚铁,化学方程式为:![]() ,
,![]() ;
;
(3)使用pH试纸测定该溶液的pH时的步骤是:用用玻璃棒蘸取该溶液滴到表面皿上的pH试纸上,再与标准比色卡对比,读出pH;
(4)硫酸亚铁和碳酸铵反应生成碳酸亚铁和硫酸铵,化学方程式为:![]() ,该反应符合两种化合物交换成分生成两种新的化合物,且有沉淀生成,属于复分解反应。
,该反应符合两种化合物交换成分生成两种新的化合物,且有沉淀生成,属于复分解反应。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案