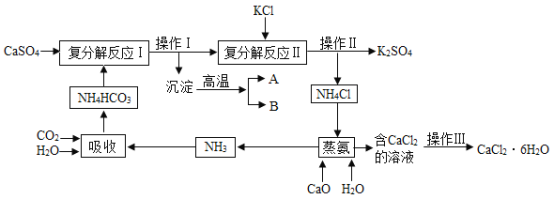
【题目】下表列出了20℃时NaCl溶解实验的一组数据
实验序号 | 水的质量/g | 所加NaCl的质量/g | 所得溶液的质量/g |
① | 10 | 2 | 12 |
② | 10 | 3 | 13 |
③ | 10 | 4 | 13.6 |
④ | 10 | 5 | 13.6 |
下列叙述正确的是( )
A.20℃时③所得溶液中NaCl的质量为4 g
B.①所得溶液的溶质的质量分数为20%
C.①②所得溶液是20℃时NaCl的不饱和溶液
D.①②③所得溶液是20℃时NaCl的不饱和溶液
【题目】碱石灰是CaO与NaOH的固体混合物,通常用于吸收CO2及干操气体。某学校实验小组在实验室取了一定量已经使用过的碱石灰样品,并对其成分进行了如下探究。
[提出猜想]该碱石灰样品中可能含有CaO、___________ (填化学式)、CaCO3、NaOH和Na2CO3.
[设计方案] (1)甲同学在烧怀中放入适量的该碱石灰样品,先加入少量水,未发现放热现象,再加入足量蒸馏水充分搅拌,静置,有白色沉淀出现,甲同学认为样品中一定含有CaCO3.你认为甲同学的结论是否严谨?理由是:______________________________。
(2)乙同学进一步设计实验并进行验证,过程如下表:
实验操作 | 实验现象 | 实验结论 |
① 从甲同学的烧杯中取少量上层清液 于试管中,向其中滴加足量________溶液。 | 有白色沉淀生成 | 样品中一定有Na2CO3 |
② 将操作①所得到的混合物,过滤,向滤液中滴加无色酚酞试液。 | 无明显现象 | 滤液中不含有NaOH |
[实验结论]你认为通过以上甲、乙两位同学的实验探究,是否可以确定该碱石灰样品的组成成分?若能,请写出其组成;若不能,请说明理由______________________________。
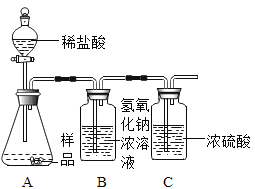
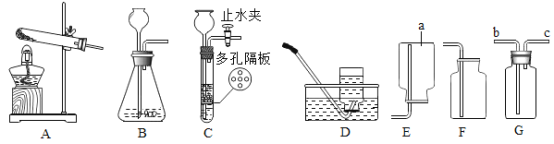
[实验反思]丙同学进一步设计了如图所示的实验装置,通过称量B装置的质量变化来测定一定量样 品与足量稀盐酸反应所生成的CO2的质量(气密性良好,每步均完全反应,操作无误)。若丙同学最终测得的CO2质量比实际值小,你认为可能原因是____________________。