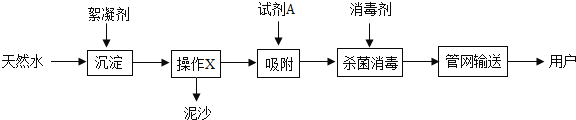
【题目】空气中氧气含量测定的再认识:
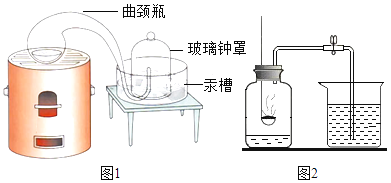
(1)[经典赏析]拉瓦锡用定量的方法研究空气的成分(实验装置如图1)。该实验中选择使用汞的优点有_____
A 汞俗称水银,常温下呈液态,安全无毒 B 能将密闭装置内空气中的氧气几乎耗尽
C 反应生成的氧化汞是固态,不影响压强 D 生成的化合物加热分解又能得到汞和氧气
(2)(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的符号表达式_______。图2中集气瓶底部的水的作用为_____。(填一点即可)但是用该方法测出的氧气含量常常低于21%。
(3)(提出问题)用该方法测出的氧气含量为什么低于21%?
(进行猜想)①装置漏气;②_____,装置内氧气有剩余;

(4)(实验与交流)为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术定时测定了实验装置(如图5)内的压强、温度和氧气浓度,三条曲线变化趋势如图6所示。X曲线表示压强变化趋势,Y曲线表示_____(填“温度”或“氧气浓度”)变化趋势。

(5)(实验探究1)已知,铁丝在纯氧中才能燃烧,反应的符号表达式为_____,一般不能在空气中燃烧,因此无法用铁丝代替红磷进行该实验。小明根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,于是进行了实验(装置如图3)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
(交流与反思)与用红磷燃烧的方法相比,用铁丝生锈的方法的主要优点_____(填字母)。
A 装置内残留的氧气更少 B 铁丝生锈比红磷燃烧反应更快 C 反应更彻底,实验结果更准确
(6)(实验探究2)小明利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4)。8分钟后测得的数据如下表:请计算出空气中氧气含量______(计算结果保留一位小数)。
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.4mL |
(7)(拓展延伸)铜能与空气中氧气、水、二氧化碳反应生成铜绿(其主要成分为:Cu2(OH)2CO3).写出生成铜绿的符号表达式_____。
(8)请计算:Cu2(OH)2CO3的相对分子质量是_____。
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是_____;
(2)表中所列3种催化剂的催化效果最佳的是_____;
(3)写出实验3中KClO3分解的化学方程式:_____;
(4)由实验1和实验4可知,KCl_____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____;
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____;
(6)用图装置测量一定量的氯酸钾和二氧化锰加热分解后产生O2的体积,实验时应_____(选填“气泡连续均匀”或“刚有气泡”)时开始收集气体。

①以下是用该装置测量收集到的气体的体积必须包括的几个步骤:
A调整量筒内外液面使之相平
B使试管和量筒内的气体都冷却至室温
C读取量筒内气体的体积
这三步操作的正确顺序是:_____(请填写步骤代号)。
②若实验结束时,量筒内的液面高于水槽中的液面,要使量筒内外液面的高度相同可采用的操作是_____(填操作方法)。
③某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为_____。
A 10.5% B 14.5% C 25.5% D 50%
【题目】化学是一门以实验为基础的科学,几位同学对化学实验非常感兴趣,请结合图表信息回答问题:
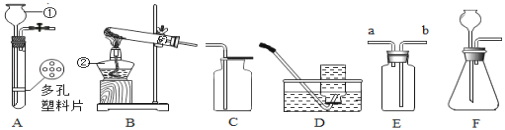
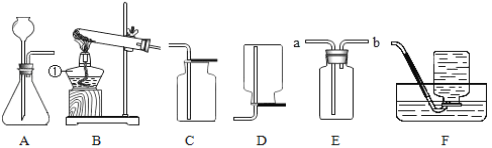
Ⅰ写出图中①②仪器的名称:①_____,②_____。
Ⅱ甲同学在实验室用加热高锰酸钾的方法制取氧气,反应的化学方程式为_____,发生装置是_____,加热时试管口应略向下倾斜的原因是_____。
Ⅲ乙同学在实验室研究二氧化碳的制备和性质。
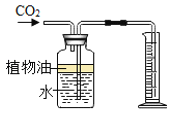
制备二氧化碳的化学方程式是_____;他选用了A而没有选用F做发生装置,是因为A的优点是_____;他用E装置收集该气体,气体应从_____(填“a”或“b”)端通入;他在收集得到二氧化碳的集气瓶中滴加适量澄清石灰水,稍作振荡,发生的现象是_____,反应的化学方程式是_____。
IV丙同学研究实验室制取二氧化碳的适宜条件(温度、酸的浓度、大理石固体的颗粒大小等因素会影响化学反应的快慢),进行了如下四组实验:
实验编号 | A | B | C | D |
mg大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
ng盐酸(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
实验A与_____对照(填编号),是为了研究固体反应物颗粒大小对反应快慢的影响;上述实验中,另一个影响反应快慢的因素是_____。
V丁同学研究了木条复燃与氧气体积分数的关系,发现不纯的氧气也能使带火星的木条复燃。他想收集一瓶混有约1/4体积空气的氧气,应该选用_____(填序号)完成实验,收集好后集气瓶中氧气的体积分数约为_____(空气中氧气的含量按照1/5计算)。
A 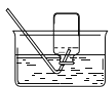 集气瓶中灌1/4的水 B
集气瓶中灌1/4的水 B 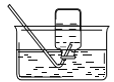 集气瓶中灌3/4的水
集气瓶中灌3/4的水
C ![]() 导管伸入到集气瓶体积的1/4处 D
导管伸入到集气瓶体积的1/4处 D ![]() 导管伸入到集气瓶体积的3/4处
导管伸入到集气瓶体积的3/4处
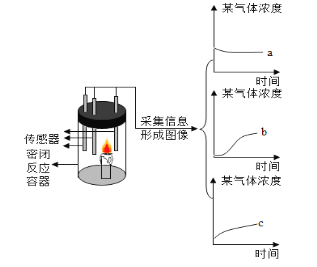
VI戊同学利用数字化实验探究蜡烛的燃烧,如图所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如下坐标图所示a、b、c。曲线_____(填“a”“b”或“c”)能够说明蜡烛燃烧消耗氧气。