【题目】教材中“分解过氧化氢制氧气的反应中二氧化的化作用”,以及“寻找新的催化剂”研究性实验,引起了化学研究小组同学们的兴趣。
(提出疑问)氧化铁能否作过氧化氢溶液分解的能化剂?如果能,其效果加何?
实验步骤 | 实验现象 |
①分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象 | A试管中产生气泡,带火星的木条复燃;B试管中无明显现象 |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象 | 试管中均产生气泡,带火星的木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得虑渣进行洗涤、干燥、称量,所得固体质量仍为ag | |
④分别量取_____过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象 |
(实验结论)(1)A中产生的气体是_____。
(2)实验2、3证明:氧化铁的质量和_____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)实验4的步骤中应填写_____。
(4)写出氧化铁催化过氧化氢分解的化学反应文字表达式_____。
(实验评价)(5)设计实验4的目的是_____。
(6)若实验4观察到D试管中产生气泡的速率更快,由此可以得到的结论是_____。
(表达与交流)(7)小组同学在常温下,将a、b、c三个试管中分别加入等量5%过氧化氢的溶液,在其他条件相同时,各滴2滴5%、10%、20%的硫酸铜溶液。绘制了产生的氧气体积和时间变化的曲线如图,请你回答:
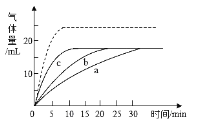
①写出两条规律性结论:_____、_____。
②若实验中所得的曲线如图中虚线所示,请推测其中可能的原因_____。
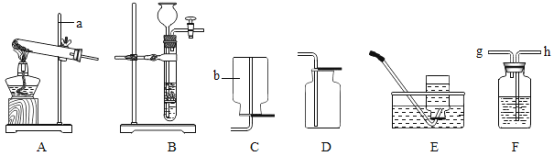
【题目】铭铭在实验室做课外活动探究实验时,发现了一个非常奇怪的现象,当他把煤炭放在如下图容器中燃烧时,发现紫红色的高锰酸钾溶液变成了无色。请你跟她一起探究原因。
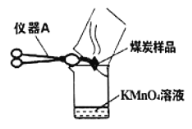
(1)(提出问题)什么使紫红色的高锰酸钾溶液褪色的?
(2)(查阅资料)煤炭燃烧能够产生二氧化碳,而且煤炭中有硫元素,还会燃烧生成二氧化硫气体。
(3)(猜想与假设)a、甲同学假设_____,b、乙同学假设:二氧化硫能使紫红色的高锰酸钾溶液褪色的。
(4)(实验与结论)两位同学为了验证自己的猜想,设计以下实验进行验证,为点燃煤炭还须用到的一种玻璃仪器是_____。
实验步骤 | 实验现象 | 实验结论 |
甲实验:取5mL稀高锰酸钾溶液于一支试管中,_____,观察现象。 | _____ | 甲同学假设不成立 |
乙实验:_____并将二氧化硫气体通入试管,观察现象。 | _____ | 乙同学假设成立 |
(5)(反思评价)从环保角度考虑,我们使用燃煤时应该怎么做?_____。