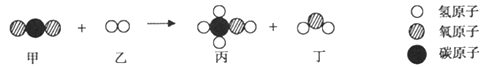
【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.
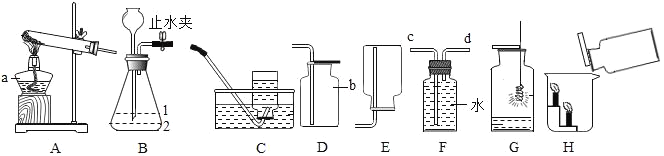
【题目】我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:
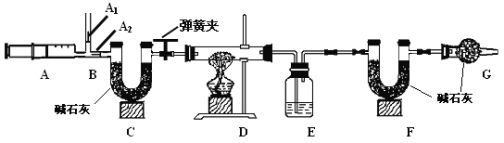
已知:1.碳酸钠比较稳定,加热不分解;
2. 2NaHCO3![]() Na2CO3 +CO2 ↑+H2O
Na2CO3 +CO2 ↑+H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,
A1打开进空气,A2关闭。
(一)实验步骤
(1)实验时,组装好装置,实验前应先 ,后续实验步骤是:
① 反复推拉注射器
② 称量E、F的质量
③ 关闭弹簧夹,加热D处试管直到反应不再进行
④ 打开弹簧夹,再次反复缓缓推拉注射器
⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。实验过程中,C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
反应前 | 反应后 |
E的质量为100.0g | E的质量为102.25g |
F的质量为50.0g | F的质量为51.1g |
则: ① 碳酸氢钠分解生成二氧化碳的质量为 g
② 碳酸氢钠的质量为 g
③ 该天然碱的化学式中a:b:c= 。