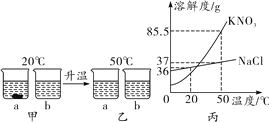
题目内容
【题目】某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如图操作流程:请回答:
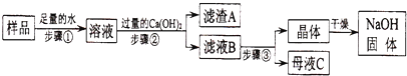
(1)步骤②反应的化学方程式为________;加入过量Ca(OH)2的目的是________
(2)滤液B中的溶质是________、________(写化学式);步骤③所包含的具体操作是加热浓缩、________、过滤.
(3)探究变质NaOH固体中碳酸钠的质量分数.
(设计实验)甲组同学:称取20.0g样品,放入足量的溶质质量分数为14.6%的稀盐酸直到反应停止,共收集到4.40g二氧化碳.
乙组同学:称取20.0g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.0g.
(解决问题)
根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:________.(请写出计算过程 Ca:40 C:12O:16H:1Na:23)
(4)(交流与反思)
在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:________.
【答案】Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 将溶液中的碳酸钠完全转化为氢氧化钠 Ca(OH)2 NaOH 降温结晶 64.6% 因为样品中有水,无法测出样品的氢氧化钠的质量
【解析】
变质的氢氧化钠常会因氢氧化钠与二氧化碳反应含有碳酸钠,碳酸钠与氢氧化钙反应会生成碳酸钙与氢氧化钠,为把碳酸钠清除的更干净一些常会加入过量的氢氧化钙.
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;将溶液中的碳酸钠完全转化为氢氧化钠.
(2)由于溶液中加入了过量的氢氧化钙,所以滤液中会含有氢氧化钠与氢氧化钙,因为这两种物质的溶解度随温度的变化差异很大,故可采用降温结晶的方式进行分离.
故答案为:Ca(OH)2;NaOH;降温结晶;
[解决问题]
设样品中碳酸钠的质量为x,
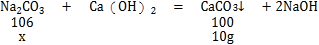
![]()
解得x=10.6g
所以:品中碳酸钠的质量分数![]()
[交流与反思]
因为样品中有水,无法测出样品的氢氧化钠的质量,所以以上数据不能计算出样品中氢氧化钠的质量分数,所以答案为:样品中有水,无法测出样品的氢氧化钠的质量.

 名校课堂系列答案
名校课堂系列答案【题目】氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
(提出问题)滤液中溶质的成分是什么?
(猜想与假设)
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想____不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ____ | 猜想三成立 |
(反思与拓展)①若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是____