【题目】如图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂)制取干燥的氧气,并用来侧定,10g某铜粉样品(含杂质碳)中铜的质量分数.回答下列问题: 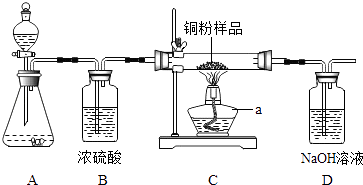
(1)仪器a的名称是 .
(2)装置A中发生反应的化学方程式是 . 装置B的作用是 .
(3)通过称量反应前后装置的质量,进行计算便可求出样品中铜的质量分数.
(4)实验完毕.小丽同学误将用剩的H202溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发现有大量的气泡产生,经检验确认产生的气体是氧气.小刚和小明两位同学对此颇感兴趣.进而展开了他们的探究之旅. 【提出问题】是哪种物质加快了H202的分解速率?
【大胆猜想】猜想Ⅰ:剩余固体中的氧化铜加快了H202溶液的分解.
猜想Ⅱ:剩余固体中的加快了H2O2溶液的分解.
猜想Ⅲ:氧化铜能做H202分解的催化剂.
(5)【实验验证】
实验方案 | 实验现象 | 分析及结论 |
实验一:将带火星的木条伸入盛有5mL 5%H2O2溶液的试管. | 带火星木条不复燃 | H202溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
实验二:向盛有5mL5%H202溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管.观察现象.待反应结束后将试管里的剩余物进行、洗涤、干燥、称量.对比反应前后氧化铜的质量 | 称得固体质量为1g. | 猜想Ⅰ成立.反应前后氧化铜的质量相等. |
实验三:向盛有5mL5%H202溶液的试管中加入1g | 没有气泡产生,带火星 | 猜想Ⅱ(填”成立“或“不成立”) |
【讨论交流】小刚同学认为,根据实验二得出的两个结论就能判断Ⅲ成立,你是否支持他的观点?并简述理由.
答: . .