【题目】某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
实验步骤 | 实验现象 | 结论 |
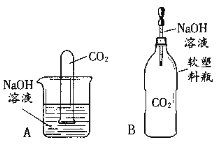
打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入 (填化学式)溶液中 | 观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
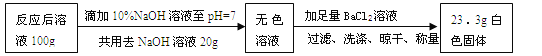
测定过程如下:
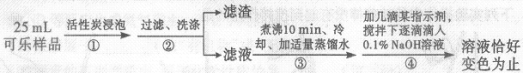
(2)步骤①用活性炭浸泡的目的是 。
(3)步骤③煮沸10分钟的目的是除尽滤液中的 。
(4)已知步骤④反应的化学方程式为H3PO4+NaOH=NaH2PO4+H2O,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:H3PO4—98;NaOH—40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果 (填“偏高”“不变”或“偏低”)。