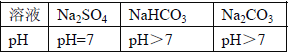��Ŀ����
����Ŀ����10�֣�ij��ѧ����Χ�ơ�����кͷ�Ӧ������ѧ���ֳ�����С�飬����ʦ�����¿�չ̽����������ǽ�ѧƬ�Σ��������ѧϰ��������д�ո������пո�
����ʾʵ�顿��һ������ϡH2SO4���뵽ʢ��NaOH��Һ���ձ��С�
��ѧ�����ݡ��÷�Ӧ�Ļ�ѧ����ʽ ��
����̽��
��������⡿ʵ����δ�۲쵽����������ͬѧ���������ʣ���Ӧ����Һ��������ʲô�أ�
���� �롿������ʴ�ҷ�������롣
����ͬѧ�IJ������£�
����һ��ֻ��Na2SO4
���������Na2SO4��H2SO4
����������
�����ģ���Na2SO4��H2SO4��NaOH
����ͬѧ�����ϲ���������ɣ���Ϊ��һ�ֲ����Dz������ġ�����Ϊ�������IJ�������һ�ֲ�˵������ ��
������ʵ�顿
��1������ͬѧȡ�ձ��е�������Һ���Թ��У��μӼ���CuSO4��Һ�������Ա仯����Һ��һ��û�� ��
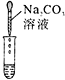
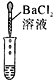
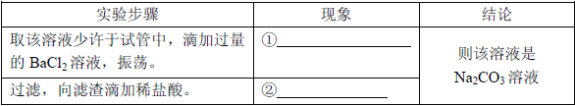
��2��Ϊ����֤������룬����ͬѧȡ�ձ��е���Һ����ѡ����ʦ�ṩ��pH��ֽ��ͭƬ��BaC12��Һ��Na2CO3��Һ���ֱ������������̽��ʵ�顣
ʵ�鷽�� | ����ҺpH | �μ�Na2CO3��Һ | �μ�BaCl2��Һ |
ʵ����� |
|
|
|
ʵ������ | ��ֽ��ɫ�����ձ�ɫ����pH��7 | ������ɫ���� | |
ʵ����� | ��Һ����H2SO4 | ��Һ����H2SO4 | ��Һ����H2SO4 |
���ó����ۡ�ͨ��̽����ȫ��ͬѧһ��ȷ�����������ȷ�ġ�
�����۷�˼����ʦ��ͬѧ�����ö��ַ�������̽�������ҵó���ȷ���۸���϶���ͬʱָ����������ʵ��̽���д����������Դ������ҷ�˼��ͬѧ�Ǿ�����˼����������������
��1��ʵ����������Ե�һ�������� ��
��2��ʵ�鷽��̽����Ҳ��һ���Dz������ģ���������ԭ���� ��
II������̽��
ȡ��������ʾʵ�顿��Ӧ���ձ��е���Һ100 g���������ʵ�飺
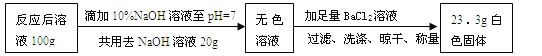
���㡾��ʾʵ�顿��Ӧ����Һ��Na2SO4�����������Ƕ��٣������г�������̣�
���𰸡���ѧ�����ݡ�H2SO4+2NaOH�TNa2SO4 +2H2O
���� �롿��������Na2SO4��NaOH ������, H2SO4 ��NaOH�ᷢ����Ӧ
������ʵ�顿��1��NaOH (2)�����ݲ���
�����۷�˼����1��pH��ֽ������Һ��
��2��BaC12��Na2SO4��ӦҲ�����ɰ�ɫ����������֤��һ����H2SO4���� II������̽����10.65%
��������
���������������ϡH2SO4���뵽ʢ��NaOH��Һ���ձ��з����ķ�Ӧ�ǣ�H2SO4+2NaOH�TNa2SO4 +2H2O�����ڷ�Ӧ�������е��������������֣��²�������Dz��뷴Ӧ�������Ƿ���ȫ��Ӧ����˸��ݷ�Ӧ��ʣ��������Ϊ������һ��ֻ��Na2SO4�����������Na2SO4��H2SO4 ������������Na2SO4��NaOH�������ṩ�IJ����ģ���Na2SO4��H2SO4��NaOH���Dz��Եģ���ΪH2SO4 ��NaOH�ᷢ����Ӧ�����ܹ��棻������Һ���Թ��У��μӼ���CuSO4��Һ�������Ա仯����Һ��һ��û��NaOH����Ϊ�������ƻ������ͭ��Ӧ�����������μ�Na2CO3��Һ��������ݲ�����˵����Һ����H2SO4��ʵ����������Ե�һ�������ǽ��вⶨ��Һ��PHֵʱpH��ֽ������Һ�У�ʵ�鷽��̽����Ҳ��һ���Dz������ģ���������ԭ����BaC12��Na2SO4��ӦҲ�����ɰ�ɫ����������֤��һ����H2SO4���ڣ�
������Һ��H2SO4��Ӧ����Na2SO4������Ϊx��ԭ100g��Ӧ����Һ�к�Na2SO4������Ϊy�� H2SO4+2NaOH �T Na2SO4 +2H2O Na2SO4 + BaC12====BaSO4��+2NaCl
80 142 142 233
20g��10% X 3.55g+Y 23.3g
�б���ʽ����80����20g��10%��=142��X 142����3.55g+Y��=233:23.3��
��ã�X =3.55g Y=10.65g
�����Ƶ���������=10.65��100��100%=10.65%