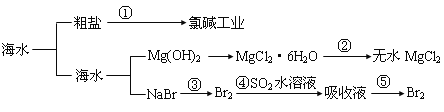
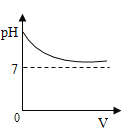
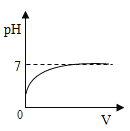
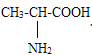��Ŀ����
����Ŀ����ѧ��ȤС���������ʵ�鷽�����ⶨij�Ѳ��ֱ��ʵ�С�մ���Ʒ�� Na2CO3 ������������
������һ�� ��ȡһ��������Ʒ�����������м��������غ���ȴ������ʣ��������������㡣
��1�������з�����Ӧ�Ļ�ѧ����ʽΪ��_______��
��2��ʵ����ȷ�����������صķ����ǣ�______��
���������� ��ȡһ��������Ʒ������С�ձ��У�������ˮ�ܽ⣻��С�ձ��м�������Ba��OH��2��Һ�����ˣ�ϴ�ӡ���������������������������㡣
��1�� ʵ�����жϳ����Ƿ���ȫ�ķ�����________��
��2�� ʵ����ϴ�ӳ����IJ�����___________��
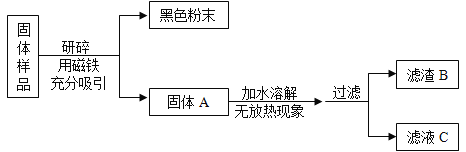
���������� ������ͼ��ʾװ�ý���ʵ�飺
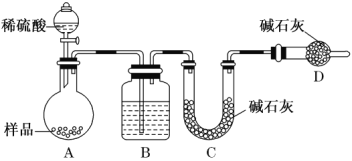
��1��B װ������ʢ�Լ���________��
��2��ʵ��ǰ��ȡ 17.90 g ��Ʒ��ʵ����� C װ������ 8.80 g������Ʒ�� Na2CO3����������Ϊ__________��
��3�����ݴ�ʵ���õ����ݣ��ⶨ���������Ϊʵ��װ�û�����һ������ȱ�ݣ���ȱ���ǣ�_____��
���𰸡�![]() ���γ���ʣ���������������0.1 g ȡ�����ϲ���Һ��һ֧�Թ��У��μ�һ�� Ba��OH��2 ��Һ���۲��Ƿ��а�ɫ�������� ��©�����������ˮ��ʹˮ��û���������ˮ������ظ����� 2��3 �� Ũ���� 29.61% ȱ��һ��A��Bװ�õ�CO2����ȫ�����ϵ�Cװ���е�װ��
���γ���ʣ���������������0.1 g ȡ�����ϲ���Һ��һ֧�Թ��У��μ�һ�� Ba��OH��2 ��Һ���۲��Ƿ��а�ɫ�������� ��©�����������ˮ��ʹˮ��û���������ˮ������ظ����� 2��3 �� Ũ���� 29.61% ȱ��һ��A��Bװ�õ�CO2����ȫ�����ϵ�Cװ���е�װ��
��������
[����һ]��1��С�մ�Ϊ̼�������׳ƣ�̼���������ڼ��������·�Ӧ����̼���ơ�ˮ�Ͷ�����̼���ݴ���д��ѧ����ʽ��ע����ƽ��������ţ�
�ʴ�Ϊ��![]() ��
��
��2����������Ƿ�ﵽ���أ��������ǰ����������������жϣ�һ��ǰ��������С��0.1g����Ϊ�ﵽ���أ�
�ʴ�Ϊ�����γ���ʣ���������������0.1 g��
[������]��1���жϳ����Ƿ���ȫ����Ҫ����Һ���Ƿ���ʣ���̼���ƣ����ȡ�ϲ���Һ���Թ��У���������������Һ���۲����ް�ɫ�������ɣ��жϳ����Ƿ���ȫ��
�ʴ�Ϊ��ȡ�����ϲ���Һ��һ֧�Թ��У��μ�һ�� Ba��OH��2 ��Һ���۲��Ƿ��а�ɫ�������ɡ�
��2��������˺������ϴ�ӷ�������Ҫ������ˮϴ�ӣ�����ˮ����û���������ȹ�����ϣ��ظ�����2��3�Σ����ϴ�ӣ�
�ʴ�Ϊ����©�����������ˮ��ʹˮ��û���������ˮ������ظ�����2��3�Ρ�
[������]��1��ϡ��������Ʒ��Ӧ�����������ơ�������̼��ˮ��������̼�ش���ˮ����������ʯ�Ҳ������ն�����̼��Ҳ������ˮ���������Ϊ��ȷ��ֻ���ն�����̼������Ҫ��������и������Һ������ΪŨ���
�ʴ�Ϊ��Ũ���ᡣ
��2��C����������Ϊ������̼��������̼������̼�����ƺ����ᷴӦ���������ɶ�����̼����˸���̼ԭ�������غ��֪��̼������̼Ԫ������+̼��������̼Ԫ������=������̼��̼Ԫ����������̼��������Ϊm����̼����������=17.90g-m�����Ը���̼Ԫ�������غ��֪��![]() ��m=5.30g��������Ʒ��̼������������=
��m=5.30g��������Ʒ��̼������������= ![]() ��
��
�ʴ�Ϊ��29.61%��
��3�����ڶ�����̼�ܶȱȿ���������������װ���ڲ�������Ҫ����һ���Խ��ڲ����������ų���װ�ã���Ҫ����������A��B�У����Ϊ�˱�֤������̼��ȫ�����գ���Ҫ����һ��A��B�в����Ķ�����̼�ų���װ�ã�
�ʴ�Ϊ��ȱ��һ��A��Bװ�õ�CO2����ȫ�����ϵ�Cװ���е�װ�á�

 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�����Ŀ����ѧʵ������ϣ���ʦ����һ����ĩ�������ɳ��ڷ����ڿ����е����ۺ;��õļ�ʯ�Ҹ������϶��ɡ���ͬѧ�����ʵ�����̽����
[�������]������Ʒ�ijɷ���ʲô?
[��������] ��1����ʯ�Ҹ������CaO��NaOH�Ļ���
��2��BaCl2��Һ�����ԡ�
[���������]
������Ʒ�п��ܺ���Fe��Fe2O3�� CaO�� NaOH��Ca(OH)2��Na2CO3��_________���������ʡ�
[����ʵ��]��ͼ
����ͬѧ������B�ijɷֽ���̽������¼����:
ʵ����� | ʵ������ | ʵ����ۼ���ѧ����ʽ |
ȡ��������B���Թ��У���������ϡ���ᣬ�����ɵ�����ͨ������ʯ��ˮ�� | ��____ ��_____ | ����:����B����Fe2O3��CaCO3��ʵ������з�Ӧ�Ļ�ѧ����ʽΪ:__ |
����ͬѧ����ҺC�ijɷֽ�����̽������¼����:
ʵ����� | ʵ������ | ʵ����� |
ȡ������ҺC���Թ��У��������BaCl2��Һ�����ã����ϲ���Һ�еμ���ɫ��̪��Һ���� | ���а�ɫ�������� �ڷ�̪��Һ����ɫ��ɺ�ɫ | ��ҺC����___ |
[���������]
��1������ͬѧʵ���м������BaCl2��Һ��Ŀ����__________��
��2��ͨ������ʵ��̽�����ù�����Ʒ����ȷ��һ�����еijɷ���_______��
����Ŀ����ͼ����������̽�����������ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������������������һ������������档�±��ж�ʵ�����������Ľ�����ȷ���ǣ�������
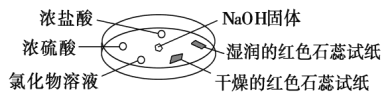
ѡ�� | ʵ������ | ���� |
�� | Ũ���ḽ���������� | NH3��HCl��Ӧ������NH4Cl���� |
�� | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
�� | �Ȼ�����Һ���к��ɫ���� | ����Һһ����FeCl3��Һ |
�� | ����ĺ�ɫʯ����ֽ����ɫ��ʪ��ĺ�ɫʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.�ڢۢ�
B.�٢ۢ�
C.�٢�
D.�ۢ�