题目内容
【题目】现有9.3g NaOH与Na2CO3的固体混合物,测得其中钠元素与碳元素的质量比为23:3.在室温下,将该混合物与50g稀硫酸混合,恰好完全反应,所得不饱和溶液的质量为57.1g,则原固体混合物中含有钠元素的质量为下列的
A.1.15g B.2.3g C.4.6g D.6.9g
【答案】C
【解析】
试题分析:生成氧气的质量为:9.3g+50g﹣57.1g=2.2g;
设混合物中碳酸钠的质量为x,
Na 2CO3 +H 2 SO4 ═Na 2SO4+CO2 ↑+H2O
106 44
x 2.2g
![]()
x=5.3g
NaOH的质量是9.3g﹣5.3g=4g
5.3gNa2CO3中钠元素的质量为5.3g×![]() ×100%=2.3g; 4g NaOH中钠元素的质量为=2.3g则原古体混合物中含有钠元素的质量为2.3g+2.3=4.6g。故选C.
×100%=2.3g; 4g NaOH中钠元素的质量为=2.3g则原古体混合物中含有钠元素的质量为2.3g+2.3=4.6g。故选C.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
【题目】探究小组利用如图所示装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当胶头滴管滴几滴液体后,能观察到气球变大的实验组合是
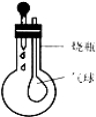
组合 | 滴管中 | 烧瓶中 |
A | H2SO4(稀) | NaOH(固) |
B | HCl(稀) | Zn(固) |
C | NaOH | CO2(气) |
D | H2SO4(浓) | H2O(液) |