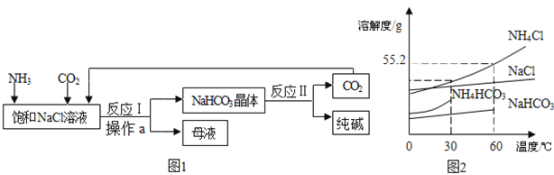
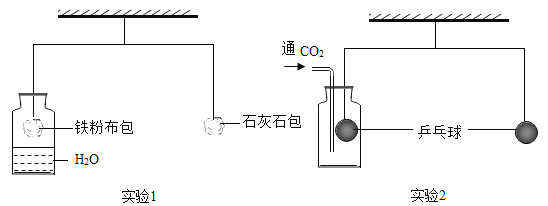
题目内容
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,将产生氨气。立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
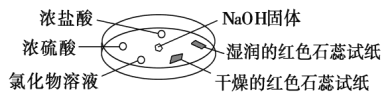
选项 | 实验现象 | 解释 |
① | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
② | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
③ | 氯化物溶液中有红褐色沉淀 | 该溶液一定有FeCl3溶液 |
④ | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.②③④
B.①③④
C.①③
D.③④
【答案】C
【解析】
①浓盐酸具有挥发性,挥发出的氯化氢气体能与氨气反应生成氯化铵固体,故产生白烟,正确;
②浓硫酸能与氨气反应生成硫酸铵,错误;
③氨气不断运动,当运动到氯化物溶液中时,氯化物溶液中产生红褐色沉淀,说明溶液中有氯化铁,铁离子与氢氧根离子结合生成了氢氧化铁红褐色沉淀,正确;
④干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝,是因为氨分子运动到此处时,氨气与水反应生成氨水,氨水中能电离出氢氧根离子,显碱性,氨气不是碱,错误。
故正确的是①③。
故选C。

 字词句篇与同步作文达标系列答案
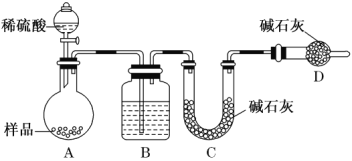
字词句篇与同步作文达标系列答案【题目】绿矾(FeSO47H2O),在医药、净水、化肥、农药等方面有广泛的应用。化学小组的同学在用绿矾配制FeSO4溶液时发现,溶液颜色会由绿变黄,于是开展了以下探究活动。
(查阅资料)
ⅰ.FeSO4溶液如果长时间显露在空气中,会与氧气发生反应转换成Fe2(SO4)3 ,色泽由最初的浅绿色或淡绿色转变成黄色。反应生成的Fe2(SO4)3遇KSCN溶液会变红。
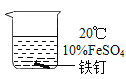
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(提出猜想)
影响FeSO4溶液与氧气反应速率的因素可能有温度、浓度、溶液酸碱性、是否有铁钉等。
(进行实验)
编号 | 实验 | 0min | 30min | 2h |
① |
| 溶液为浅绿色 | 溶液略显黄色 | 溶液黄色略有加深 |
② |
| 溶液为浅绿色 | 溶液明显变黄 | 溶液黄色明显加深 |
③ |
| 溶液立即变黄 | ||
④ |
| 溶液为浅绿色 | 溶液明显变黄,振荡后无变化 | 溶液黄色明显加深,振荡后无变化 |
⑤ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后, 略显红色 |
⑥ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后,略显红色,振荡后溶液变为浅绿色 |
(解释与结论)
(1)FeSO4溶液为浅绿色或淡绿色,Fe2(SO4)3溶液为黄色,可见这两种盐溶液的颜色差异与____元素有关。
(2)实验①中实验温度T=___℃
(3)通过对比实验②和③,得出的结论是 ___________。
(4)欲得出“稀硫酸和铁钉共同存在下才能有效防止FeSO4溶液变质”的结论,需要对比_______(填写实验编号)。
(5)实验⑤中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。![]() ______
______
(6)下列说法正确的是________。
A 其他条件相同,溶液酸性增强,FeSO4溶液变质加快
B 其他条件相同,FeSO4溶液浓度越大,变质越快
C 实验⑥中,滴加KSCN 溶液后,略显红色,振荡后溶液变为浅绿色,可能是发生了反应![]()