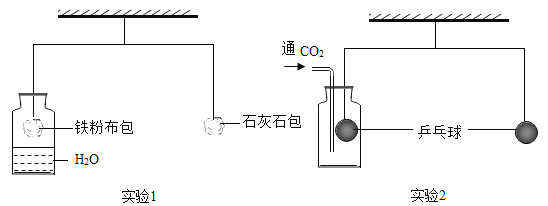
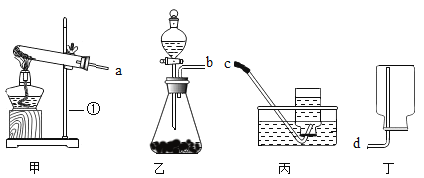
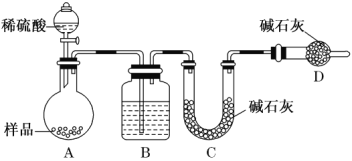
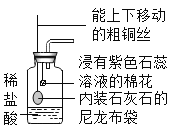
题目内容
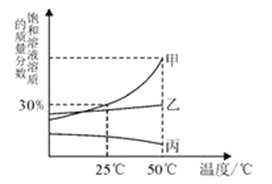
【题目】向一定量的Ba(OH)2溶液中逐滴加入稀H2SO4下列图象中V表示加入稀H2SO4的体积,其中正确的是
A. 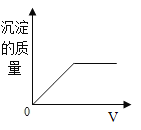
B. 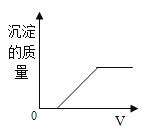
C. 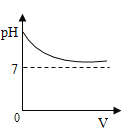
D. 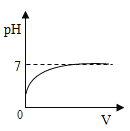
【答案】A
【解析】
A、硫酸与氢氧化钡反应会生成水与硫酸钡沉淀,随着反应的进行沉淀量不断增大,直至恰好反应,沉淀量不再改变,图象正确,故此选项正确;
B、硫酸与氢氧化钡反应会生成水与硫酸钡沉淀,一开始就有沉淀生成,图象错误,故此选项错误;
C、氢氧化钡显碱性,随着酸量的增加溶液的碱不断减少,pH值变小,直至恰好反应pH=7,再加入稀硫酸酸性不断增强,pH小于7,图象错误,故此选项错误;
D、氢氧化钡显碱性,随着酸量的增加溶液的碱不断减少,pH值变小,直至恰好反应pH=7,再加入稀硫酸酸性不断增强,pH小于7,图象错误,故此选项错误。
故选A。

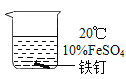
【题目】绿矾(FeSO47H2O),在医药、净水、化肥、农药等方面有广泛的应用。化学小组的同学在用绿矾配制FeSO4溶液时发现,溶液颜色会由绿变黄,于是开展了以下探究活动。
(查阅资料)
ⅰ.FeSO4溶液如果长时间显露在空气中,会与氧气发生反应转换成Fe2(SO4)3 ,色泽由最初的浅绿色或淡绿色转变成黄色。反应生成的Fe2(SO4)3遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(提出猜想)
影响FeSO4溶液与氧气反应速率的因素可能有温度、浓度、溶液酸碱性、是否有铁钉等。
(进行实验)
编号 | 实验 | 0min | 30min | 2h |
① |
| 溶液为浅绿色 | 溶液略显黄色 | 溶液黄色略有加深 |
② |
| 溶液为浅绿色 | 溶液明显变黄 | 溶液黄色明显加深 |
③ |
| 溶液立即变黄 | ||
④ |
| 溶液为浅绿色 | 溶液明显变黄,振荡后无变化 | 溶液黄色明显加深,振荡后无变化 |
⑤ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后, 略显红色 |
⑥ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后,略显红色,振荡后溶液变为浅绿色 |
(解释与结论)
(1)FeSO4溶液为浅绿色或淡绿色,Fe2(SO4)3溶液为黄色,可见这两种盐溶液的颜色差异与____元素有关。
(2)实验①中实验温度T=___℃
(3)通过对比实验②和③,得出的结论是 ___________。
(4)欲得出“稀硫酸和铁钉共同存在下才能有效防止FeSO4溶液变质”的结论,需要对比_______(填写实验编号)。
(5)实验⑤中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。![]() ______
______
(6)下列说法正确的是________。
A 其他条件相同,溶液酸性增强,FeSO4溶液变质加快
B 其他条件相同,FeSO4溶液浓度越大,变质越快
C 实验⑥中,滴加KSCN 溶液后,略显红色,振荡后溶液变为浅绿色,可能是发生了反应![]()