题目内容
【题目】已知氨基丙酸的结构简式为
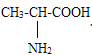
它可与NaOH反应生成氨基丙酸钠,其化学式为C3H6O2NNa又知味精的主要成分是谷氨酸一钠,它可由谷氨酸与NaOH反应生成,其结构简式为:![]()
已知它具有下列有关性质:①常态下为白色晶体,含有一分子结晶水,无气味,易溶于水,有肉类鲜味;②在碱性条件下会生成似成非成、似涩非涩的谷氨酸二钠,鲜味降低;③在150°C时失去结晶水,在210°C时生成对人体有害的焦谷氨酸盐,并在270°C左右进一步分解。根据以上信息填空:
(1)氨基丙酸与氢氧化钠反应的化学方程式为_____;
(2)写出谷氨酸二钠结构简式:_____;
(3)使用味精适宜的条件是_____。
【答案】![]()
![]() 150℃以下
150℃以下
【解析】
(1)氨基丙酸与氢氧化钠反应生成氨基丙酸钠和水,反应的化学方程式为![]() ;
;
(2)谷氨酸二钠结构简式,是通过图示计算出钠原子、氧原子、碳原子、氮原子、氢原子个数,所以结构简式是![]() ,即
,即![]() ;
;
(3)味精在150°C时失去结晶水,在210℃时生成对人体有害的焦谷氨酸盐,所以使用味精适宜的条件是在150℃以下。

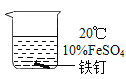
【题目】绿矾(FeSO47H2O),在医药、净水、化肥、农药等方面有广泛的应用。化学小组的同学在用绿矾配制FeSO4溶液时发现,溶液颜色会由绿变黄,于是开展了以下探究活动。
(查阅资料)
ⅰ.FeSO4溶液如果长时间显露在空气中,会与氧气发生反应转换成Fe2(SO4)3 ,色泽由最初的浅绿色或淡绿色转变成黄色。反应生成的Fe2(SO4)3遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(提出猜想)
影响FeSO4溶液与氧气反应速率的因素可能有温度、浓度、溶液酸碱性、是否有铁钉等。
(进行实验)
编号 | 实验 | 0min | 30min | 2h |
① |
| 溶液为浅绿色 | 溶液略显黄色 | 溶液黄色略有加深 |
② |
| 溶液为浅绿色 | 溶液明显变黄 | 溶液黄色明显加深 |
③ |
| 溶液立即变黄 | ||
④ |
| 溶液为浅绿色 | 溶液明显变黄,振荡后无变化 | 溶液黄色明显加深,振荡后无变化 |
⑤ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后, 略显红色 |
⑥ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后,略显红色,振荡后溶液变为浅绿色 |
(解释与结论)
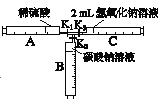
(1)FeSO4溶液为浅绿色或淡绿色,Fe2(SO4)3溶液为黄色,可见这两种盐溶液的颜色差异与____元素有关。
(2)实验①中实验温度T=___℃
(3)通过对比实验②和③,得出的结论是 ___________。
(4)欲得出“稀硫酸和铁钉共同存在下才能有效防止FeSO4溶液变质”的结论,需要对比_______(填写实验编号)。
(5)实验⑤中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。![]() ______
______
(6)下列说法正确的是________。
A 其他条件相同,溶液酸性增强,FeSO4溶液变质加快
B 其他条件相同,FeSO4溶液浓度越大,变质越快
C 实验⑥中,滴加KSCN 溶液后,略显红色,振荡后溶液变为浅绿色,可能是发生了反应![]()
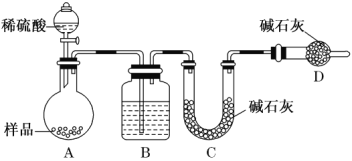
【题目】生活中铜器保存不当易生成铜锈,又称铜绿,其主要成分是碱式碳酸铜(Cu2(OH)2CO3),碱式碳酸铜是一种用途广泛的工业原料。
(1)根据铜绿的化学式推断,铜生锈的条件除了水和氧气外,还需要_________(填化学式).
(2)铜绿不稳定,在加热的条件下生成氧化铜、水和二氧化碳,写出该反应的化学方程式 ____。
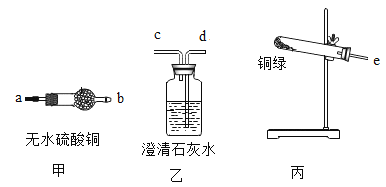
(3)用甲、乙、丙三套装置组合后检验铜绿分解的生成物中有水和二氧化碳,仪器的接口顺序为e- ____— __— ___。(资料链接:无水硫酸铜遇水变蓝色)
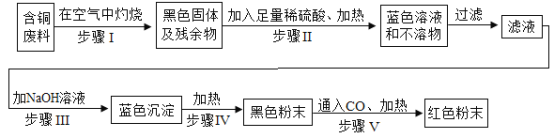
(4)用辉铜矿(主要成分为Cu2S,还含有少量Fe2O3、SiO2 杂质)制备铜绿流程如下:
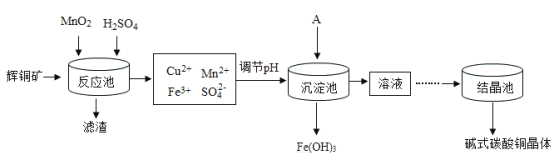
①部分金属阳离子生成氢氧化物沉淀的 pH 范围如下表所示。调节 pH,使Fe3+完全沉淀而Cu2+不沉淀,则 pH 的范围应控制在 _____。
氢氧化物 | Mn(OH)2 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 8.3 | 2.7 | 4.4 |
完全沉淀的pH | 9.8 | 3.7 | 6.4 |
②(Ⅱ)因为辉铜矿中含有少量Fe2O3,Fe2O3可与稀硫酸反应,故反应池中发生的反应还有:
(Ⅰ)2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O。
_____。
③结晶池中温度须控制在 70℃-80℃,如果出现_________(填写实验现象),说明温度过高。
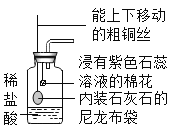
(5)为了从某铜绿样品中制得金属铜,同时测定碱式碳酸铜的含量。小王同学设计了如下图所示的实验装置,回答下列问题:(资料链接:无水碳酸铜遇水变蓝色)
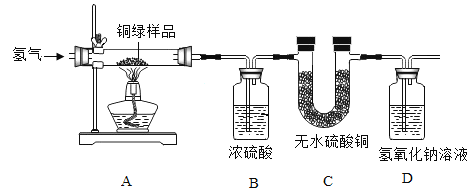
Ⅰ.实验开始时,应先_________再_________(填序号),观察到玻璃管中出现红色固体。
①通入H2 排尽空气 ②点燃酒精灯加热
Ⅱ.碱式碳酸铜晶体化学式:CuCO3·Cu(OH)2·2H2O,相对分子质量为 258。若样品为 20g,反应结束后 B、D 装置分别增重 2.7g 和 2.2g。
计算:①生成二氧化碳 _____g。
②该样品中碱式碳酸铜晶体的纯度。________(写出计算过程,保留到小数点后一位)