题目内容
【题目】某化学小组同学利用盐酸和氧化铜进行实验的过程中,出现了意想不到的现象:发现溶液变为了绿色。 为探究溶液变绿的原因,进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体②铜离子(Cu2+)在水溶液中呈蓝色
(进行实验)
实验 1:取 2mL 不同浓度的盐酸分别加入到盛有 0.2g 氧化铜的试管中,进行实验。
序号 | 浓盐酸与水的 体积比 | 现象 |
1-1 | 1:1 | 30 秒后溶液变为绿色,无黑色固体剩余 |
1-2 | 1:2 | 1 分钟后溶液变为蓝绿色, 无黑色固体剩余 |
1-3 | 1:3 | 2 分钟后溶液变为蓝色,无黑色固体剩余 |
1-4 | 1:4 | 4 分钟后溶液变为浅蓝色,有黑色固体剩余且不再减少 |
实验 2:取 2mL 稀盐酸(浓盐酸与水的体积比为 1:3)加入到盛有 0.2g 氧化铜的试管中,实验装置如下。
序号 | 2-1 | 2-2 |
操作 |
|
|
现象 | 2 分钟后溶液变为蓝色,无 现象黑色固体剩余 | 10 秒后溶液变为浅绿色,无 黑色固体剩余 |
(解释与结论)
(1)补全氧化铜与盐酸反应的化学方程式:CuO+2HCl ==== CuCl2+_________________
(2)实验 1 中配制不同浓度的盐酸时,需要使用的仪器包括______________________(填序号,下同)。
A 量筒 B 烧杯 C 酒精灯 D 玻璃棒
(3)实验 1 的目的是_______________。
(4)结合实验 1 和实验 2,得出的结论是______________________。
(反思与评价)
(span>5)实验 1-4 中,“有黑色固体剩余”的原因是___________________。
(6)实验 1 中若进行浓盐酸与水的体积比为 1:5 的实验,充分反应后可能出现的现象为 ______________。
A 溶液变为绿色,无黑色固体剩余
B 溶液变为更浅的蓝色,无黑色固体剩余 C.溶液变为更浅的蓝色,有黑色固体剩余
【答案】H2O ABD 比较不同浓度盐酸对氧化铜和盐酸反应的影响 氧化铜和盐酸反应,盐酸浓度和温度不同,生成氯化铜溶液的颜色也不同 盐酸浓度太低,反应停止 C
【解析】
(1)氧化铜与盐酸反应生成氯化铜和水,化学方程式:CuO+2HCl ==== CuCl2+H2O;
(2)实验 1 中配制不同浓度的盐酸时,需要使用的仪器包括量筒、烧杯 、玻璃棒,故选ABD;
(3)实验 1 的目的是比较不同浓度盐酸对氧化铜和盐酸反应的影响。
(4)结合实验 1 和实验 2,得出的结论是氧化铜和盐酸反应,盐酸浓度和温度不同,生成氯化铜溶液的颜色也不同。
【反思与评价】
(5)实验 1-4 中,“有黑色固体剩余”的原因是盐酸浓度太低,反应停止。
(6)实验 1 中若进行浓盐酸与水的体积比为 1:5 的实验,充分反应后可能出现的现象为 溶液变为更浅蓝色,有黑色固体剩余且不再减少,故选C。

 阅读快车系列答案
阅读快车系列答案【题目】(6分)某校同学开展了如下“溶液酸碱性的检验”的实验活动:

(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称 ;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是 ;
(2)用PH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”“中性”或“碱性”)溶液,白醋pH (填“>””<”或”=”)7;
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”“B”或“C”,下同),可能导致北侧溶液pH数值发生改变的错误操作是 。
【题目】同学们在帮老师整理实验室时,发现石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
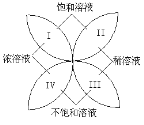
(资料)①表是几种物质常温时的溶剂能力
②酚酞试剂遇碱性溶液变红色:石灰水溶液显碱性
OH﹣ | Cl﹣ | CO32﹣ | NO3﹣ | |
Ca2+ | 微 | 溶 | 不 | 溶 |
(1)对白色粉末成分的猜想和成因
白色粉末的成分 | 形成的原因 |
可能是CaCO3 | 反应的化学方程式为:_____ |
可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
经过反复思考,同学们认为白色粉末还可能是二者的混合物.
(2)设计实验:甲同学取白色粉末装入试管中,加入少量水震荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3,有人认为甲同学的结论不严密,理由是_____.为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤 | 可能观察到的现象 | 结论 |
取上述试管中的上次清夜,滴加1~2滴无色酚酞试液 | _____ | _____ |
向上述试管中的残留固体中加入稀盐酸 | _____ | 白色粉末_____(“有”或“无”)CaCO3 |
由上述实验可知白色粉末的成分是:_____. | ||
(3)实际应用:向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到4.4g二氧化碳气体,试计算反应消耗的碳酸钙的质量_____.
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
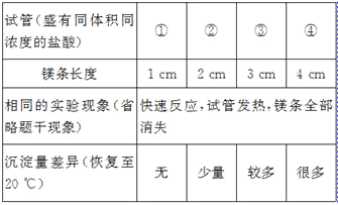
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |