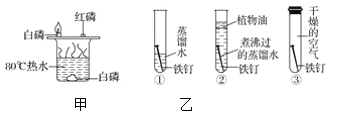
��Ŀ����
����Ŀ��ij��ĿѧϰС�����������̽����
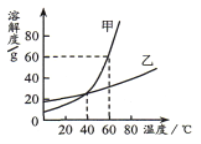
���������ϣ�����Һ������Ũ��Խ������Խǿ���絼��Խ���Ȼ�������ˮ���γ������ƶ���Cl-��Ca2+��
�ڼ�������Ҫ�ɷ���CaCO3,�����ɷֶ�ʵ��Ӱ����Բ��ơ�
�ۼ����������ݺͺ������෴Ӧ�Ļ�ѧԭ�����ơ�
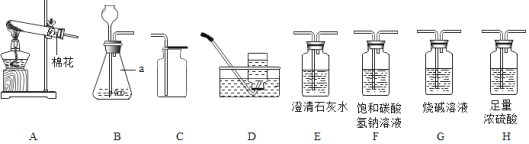
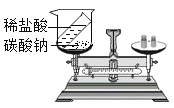
��ʵ��һ������������һ�����ʵļ�������ʢ������ϡ������ձ��У��ɹ۲쵽����һ��ð����һ�߳������ף�һ����������ϸ������ӽ�Һ��ʱ���³���
(1)ð���ݵ�ԭ��_____(��ѧ����ʽ��ʾ)��
��ʵ�����
�������ܽ����ձ��м�������ˮ������絼�ʴ����������뵰�Ƿۣ����裬��õ絼����ʱ��ı仯��ͼһ��

(2)�����Ŀ����______
(3)��ͼ��,a-b�ε絼�ʱ仯��ԭ��______
��ʵ�����������Ǵ�������̽�����������ܷ�Ԥ��ȣ�ݡ�
������֪����������(�����ɷ�ΪNaF)�뵰�Ƿ�Ӧ�ڱ������ɷ����Ʊ����㡣��Ӧ�Ļ�ѧ����ʽΪ��CaCO3+2NaF=CaF2+Na2CO3
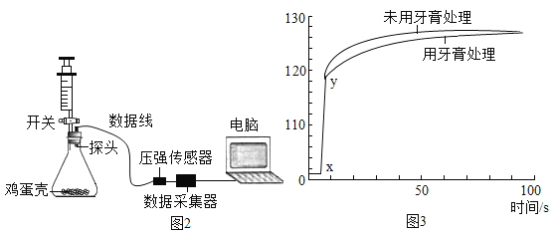
(4)�ȼ����ͼװ��������,������______���ٳ�ȡ0.50g�����ദ�����ĵ���(������Һ���ݡ�ϴ�ӡ�����)������ƿ�У���ע������ȡ20mL3.5%������(ģ���γ�ȣ�ݵ��ᾳ)�����Ӻ�װ�ã�����,���������ѹ����ƿ���رտ��أ����ѹǿ��ʱ��ı仯��ͼ��ʾ������δ�����ദ���ĵ������ظ�����ʵ�顣
(5)��ͼ��x-y��ѹǿ�������Ҫԭ��______��
(6)����ʵ���������ݷ���������δ�����ദ���ĵ������ظ�����ʵ���������______��
���𰸡�CaCO3+2HCl=CaCl2+H2O+CO2�� ����Ӵ�������ӿ��ܽ����ʣ�����ܽ� �����в���CaCO3��Ӧ�ܽ⣬��Һ������Ũ�����������ܽ�ӽ����ͣ�����Ũ����������� ���أ������������ƶ���Ҳ�ɣ�ע�����������ɿ������ص�ԭλ��˵�����������ã����ƺ����𰸾����֣� ̼���������ᷴӦ������CO2���壬ʹƿ��ѹǿ���� �Ա�
��������
[ʵ��һ] (1)ð���ݵ�ԭ��̼�����ϡ���ᷴӦ���ɶ�����̼���壬����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2����
[ʵ���]
(2)�����Ŀ��������Ӵ�������ӿ��ܽ����ʣ�����ܽ⣻
(3)��ͼ��,a-b�ε絼�ʱ仯��ԭ�����в���CaCO3��Ӧ�ܽ⣬��Һ������Ũ�����������ܽ�ӽ����ͣ�����Ũ�����������
[ʵ����]
(4)�ȼ����ͼװ��������,�����Ǵ��أ������������ƶ���Ҳ�ɣ�ע�����������ɿ������ص�ԭλ��˵�����������ã����ƺ����𰸾����֣���
(5)��ͼ��x-y��ѹǿ�������Ҫԭ��̼���������ᷴӦ������CO2���壬ʹƿ��ѹǿ����
��
(6)����ʵ���������ݷ���������δ�����ദ���ĵ������ظ�����ʵ��������ǶԱȡ�

 �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�����Ŀ��ij��ѧС��ͬѧ�������������ͭ����ʵ��Ĺ����У����������벻������������Һ��Ϊ����ɫ�� Ϊ̽����Һ���̵�ԭ����ϵ��ʵ�顣
���������ϣ�������ͭ��CuO��Ϊ��ɫ������ͭ���ӣ�Cu2+����ˮ��Һ�г���ɫ
������ʵ�飩
ʵ�� 1��ȡ 2mL ��ͬŨ�ȵ�����ֱ���뵽ʢ�� 0.2g ����ͭ���Թ��У�����ʵ�顣
��� | Ũ������ˮ�� ����� | ���� |
1-1 | 1:1 | 30 �����Һ��Ϊ��ɫ����ɫ����ʣ�� |
1-2 | 1:2 | 1 ���Ӻ���Һ��Ϊ����ɫ�� ��ɫ����ʣ�� |
1-3 | 1:3 | 2 ���Ӻ���Һ��Ϊ��ɫ����ɫ����ʣ�� |
1-4 | 1:4 | 4 ���Ӻ���Һ��Ϊdz��ɫ���к�ɫ����ʣ���Ҳ��ټ��� |
ʵ�� 2��ȡ 2mL ϡ���ᣨŨ������ˮ�������Ϊ 1:3�����뵽ʢ�� 0.2g ����ͭ���Թ��У�ʵ��װ�����¡�
��� | 2-1 | 2-2 |
���� |
|
|
���� | 2 ���Ӻ���Һ��Ϊ��ɫ���� �����ɫ����ʣ�� | 10 �����Һ��Ϊdz��ɫ���� ��ɫ����ʣ�� |
����������ۣ�
��1����ȫ����ͭ�����ᷴӦ�Ļ�ѧ����ʽ��CuO+2HCl ==== CuCl2+_________________
��2��ʵ�� 1 �����Ʋ�ͬŨ�ȵ�����ʱ����Ҫʹ�õ���������______________________������ţ���ͬ����
A ��Ͳ B �ձ� C �ƾ��� D ������
��3��ʵ�� 1 ��Ŀ����_______________��
��4�����ʵ�� 1 ��ʵ�� 2���ó��Ľ�����______________________��
����˼�����ۣ�
��span>5��ʵ�� 1-4 �У����к�ɫ����ʣ������ԭ����___________________��
��6��ʵ�� 1 ��������Ũ������ˮ�������Ϊ 1:5 ��ʵ�飬��ַ�Ӧ����ܳ��ֵ�����Ϊ ______________��
A ��Һ��Ϊ��ɫ����ɫ����ʣ��
B ��Һ��Ϊ��dz����ɫ����ɫ����ʣ�� C����Һ��Ϊ��dz����ɫ���к�ɫ����ʣ��