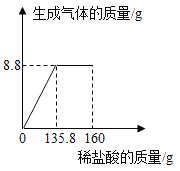
题目内容
【题目】市售塑料袋有的是用聚乙烯[(CH2CH2)n]制成,有的是用聚氯乙烯[(CH2CHCl)n]制成,通过查阅资料可知:(CH2CHCl)n+![]() O2
O2![]() 2nCO2+nH2O+nHCl,其中n是上千或上万的数值;HCl气体极易溶于水,有刺鼻气味,其水溶液即是盐酸;鉴别盐酸的方法是加入AgNO3溶液,观察是否产生白色沉淀.
2nCO2+nH2O+nHCl,其中n是上千或上万的数值;HCl气体极易溶于水,有刺鼻气味,其水溶液即是盐酸;鉴别盐酸的方法是加入AgNO3溶液,观察是否产生白色沉淀.
①通过点燃的方法可以鉴别聚乙烯和聚氯乙烯.如果塑料袋点燃时有强烈的刺鼻气味,这种塑料袋可能是由________制成的.
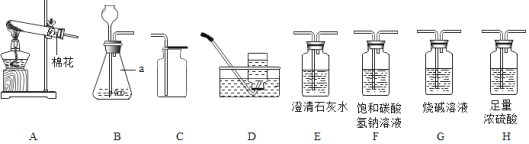
②某同学设计了如下图所示实验来探究塑料燃烧的产物.
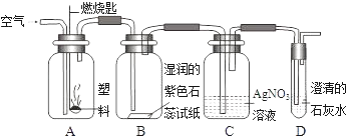
若A瓶燃烧的是聚氯乙烯塑料,在B瓶中可以看到的现象是________,C、D两瓶中发出反应的化学方程式为________、________;
若A瓶中用的是聚乙烯塑料,则在C瓶中能观察到的现象是________.
【答案】聚氯乙烯 试纸变红,瓶内壁有水雾(或瓶内有白雾)产生 HCl+AgNO3=AgCl↓+HNO3 CO2+Ca(OH)2=CaCO3↓+H2O 溶液中没有白色沉淀且有气泡冒出
【解析】
聚氯乙烯因含氯元素所以在燃烧时,会有刺激性气味冒出.在检验聚氯乙烯反应的产物时,用紫色石蕊试纸检验有酸性气体产生.这时产生的气体还能使硝酸银溶液变浑浊,所以确定含有氯离子,有氯化氢气体产生.产生使澄清石灰水变浑浊的气体,说明产生了二氧化碳气体.而聚乙烯在燃烧时不产生氯化氢气体.
故答案为:①聚氯乙烯;②试纸变红,瓶内壁有水雾(或瓶内有白雾)产生;
HCl+AgNO3=AgCl↓+HNO3,CO2+Ca(OH)2=CaCO3↓+H2O;
溶液中没有白色沉淀且有气泡冒出.

【题目】某化学小组同学利用盐酸和氧化铜进行实验的过程中,出现了意想不到的现象:发现溶液变为了绿色。 为探究溶液变绿的原因,进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体②铜离子(Cu2+)在水溶液中呈蓝色
(进行实验)
实验 1:取 2mL 不同浓度的盐酸分别加入到盛有 0.2g 氧化铜的试管中,进行实验。
序号 | 浓盐酸与水的 体积比 | 现象 |
1-1 | 1:1 | 30 秒后溶液变为绿色,无黑色固体剩余 |
1-2 | 1:2 | 1 分钟后溶液变为蓝绿色, 无黑色固体剩余 |
1-3 | 1:3 | 2 分钟后溶液变为蓝色,无黑色固体剩余 |
1-4 | 1:4 | 4 分钟后溶液变为浅蓝色,有黑色固体剩余且不再减少 |
实验 2:取 2mL 稀盐酸(浓盐酸与水的体积比为 1:3)加入到盛有 0.2g 氧化铜的试管中,实验装置如下。
序号 | 2-1 | 2-2 |
操作 |
|
|
现象 | 2 分钟后溶液变为蓝色,无 现象黑色固体剩余 | 10 秒后溶液变为浅绿色,无 黑色固体剩余 |
(解释与结论)
(1)补全氧化铜与盐酸反应的化学方程式:CuO+2HCl ==== CuCl2+_________________
(2)实验 1 中配制不同浓度的盐酸时,需要使用的仪器包括______________________(填序号,下同)。
A 量筒 B 烧杯 C 酒精灯 D 玻璃棒
(3)实验 1 的目的是_______________。
(4)结合实验 1 和实验 2,得出的结论是______________________。
(反思与评价)
(span>5)实验 1-4 中,“有黑色固体剩余”的原因是___________________。
(6)实验 1 中若进行浓盐酸与水的体积比为 1:5 的实验,充分反应后可能出现的现象为 ______________。
A 溶液变为绿色,无黑色固体剩余
B 溶液变为更浅的蓝色,无黑色固体剩余 C.溶液变为更浅的蓝色,有黑色固体剩余