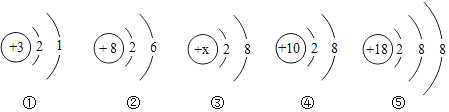
题目内容
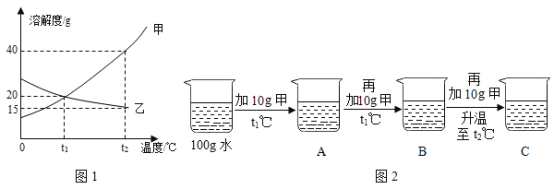
【题目】如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
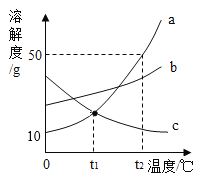
A.t2℃时,30g a能溶解于50g水中形成80g溶液
B.b中混有少量a时,应采用降温结晶的方法提纯b
C.t1℃时,a与c两种物质的饱和溶液中溶质质量相同
D.t2℃时,a、b、c的饱和溶液降温到t1℃时,其溶质质量分数大小为:b>a>c
【答案】D
【解析】
A、t2℃时a的溶解度是50g,30ga物质加入到50g水中只能溶解25g,形成溶液的质量是25g+50g=75g,故A错误;
B、a的溶解度受温度影响大,适合采用降温结晶(冷却热饱和溶液法)来获取晶体,b的溶解度受温度影响小,适合采用蒸发结晶来获取晶体,所以提纯b采用蒸发结晶,故B错误;
C、t1℃时,a、c两种物质的饱和溶液中溶质的质量不一定相等,因为没有指明是等质量的饱和溶液,故C错误;
D、将t2℃时a、b、c三种物质的饱和溶液的溶质质量分数a>b>c,降温到t1℃时,b、a仍然是饱和溶液,且b的溶解度大于a的溶解度,c为不饱和溶液,因此溶液的溶质质量分数为b>a>c,故D正确。
故选D。

练习册系列答案
相关题目