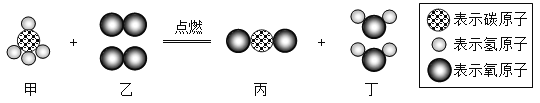
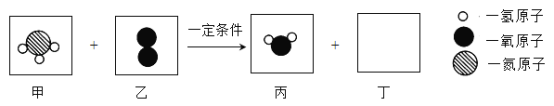
题目内容
【题目】溶液与人们的生产、生活密切相关。
(1)将少量下列物质分别放入水中,充分搅拌,可以得到溶液的是___________(填字母)。
A 泥土 B 汽油 C 面粉 D 蔗糖
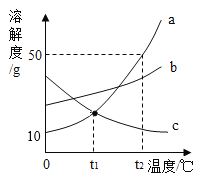
(2)如图1所示为甲、乙两种固体物质的溶解度曲线图。
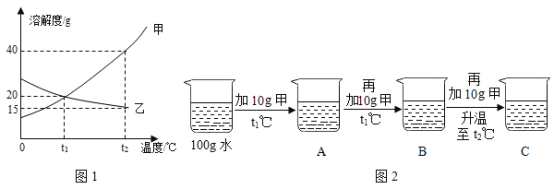
①某同学按图2进行实验,得到相应温度下的A、B、C溶液,A、B、C三种溶液中属于饱和溶液的是____________(填字母)。
②向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为_________(只列出表达式)。
③将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中,甲溶液的溶质质量分数____________(选填“>”“=”或“<”)乙溶液。
【答案】D B ![]() (或:
(或:![]() ) >
) >
【解析】
(1)溶液是均一稳定的混合物,泥土、汽油、面粉不溶解不能形成溶液,蔗糖能形成均一稳定的混合物,能形成溶液,故填:D。
(2)①t1℃甲溶解度是20g,A中10g甲是不饱和溶液,B中20g甲刚好饱和,C升温t2℃甲溶解度是40g,30g甲全部溶解,且不饱和,故属于饱和溶液的是B,故填:B。
②t2℃甲溶解度是40g,向溶液C中再加入25g甲,溶液饱和,所得溶液中溶质的质量分数为 ![]() ,故填:
,故填:![]() 。
。
③将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,甲溶解度变小,溶质结晶析出,还是饱和溶液,乙溶解度变大,变为不饱和溶液,溶质质量分数不变,甲降温之后溶解度大于乙降温前溶解度,故溶质质量分数甲>乙,故填:>。

 名校课堂系列答案
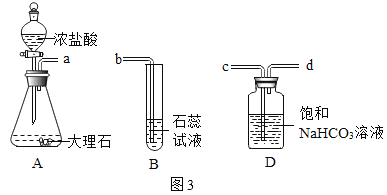
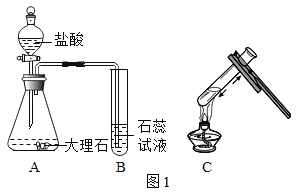
名校课堂系列答案【题目】化学小组用图1装置验证二氧化碳与水的反应。
盐酸浓度 | 观察到的现象 | |
甲组 | 浓盐酸(36.5%) | B中石蕊溶液由紫色变成红色 C中石蕊溶液没有变为紫色 |
乙组 | 稀盐酸(13.5%) | B中石蕊溶液由紫色变为红色 C中石蕊溶液变为紫色 |
(1)A中反应的化学方程式为_____。
(2)乙组C中反应的化学方程式为_____。
(讨论与交流)同学们认为甲组C中石蕊溶液没有变为紫色,是因为浓盐酸挥发出过多的HCl溶于石蕊溶液。
(提出猜想)盐酸的挥发性与浓度有关。
(进行实验)用图2装置研究不同浓度盐酸的挥发性。用离子传感器测定烧杯中所得溶液的氯离子浓度(氯离子浓度可以近似表示挥发出的HCl的量),实验数据见下表。
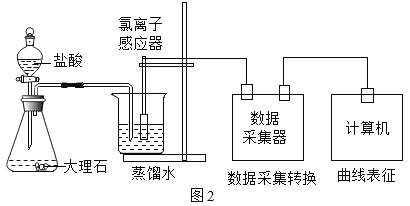
盐酸浓度与氯离子浓度的对应关系(相同时间内测得)
盐酸浓度(%) | 13.5 | 20 | 26.2 | 29.2 | 32.2 | 36.5 |
氯离子浓度(mg/L) | 1.1 | 1.4 | 3.7 | 19.0 | 59.8 | 209.2 |
分析表中数据,能够得出盐酸的挥发性与浓度的关系是_____。
(得出结论)猜想正确
(实验反思)甲组石蕊溶液变红不能证明二氧化碳与水反应。
(实验改进)甲组同学在装置A与装置B之间连接装置D。三个装置之间导管口的连接顺序是:a→_____ →_____→b。选择饱和NaHCO3溶液除杂的原因是_____。