题目内容
【题目】向盛有HCl和CuCl2混合溶液的烧杯中逐滴加NaOH溶液至过量。下列图像错误的是
A.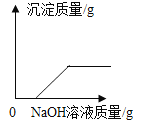
B.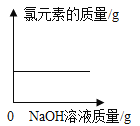
C.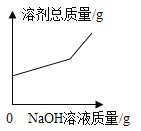
D.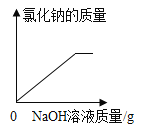
【答案】C
【解析】
A. 向盛有HCl和CuCl2混合溶液的烧杯中逐滴加NaOH溶液至过量,NaOH溶液先与稀HCl反应生成氯化钠和水,待稀HCl反应完以后,NaOH溶液再与CuCl2溶液反应生成氢氧化铜沉淀和氯化钠,故开始不生成沉淀,CuCl2溶液反应完以后,沉淀质量不再增多,此选项正确;
B. 化学反应遵守质量守恒定律,反应前后各种元素的质量相等,此选项正确;
C.原来混合溶液中溶剂的量是一定量,首先发生的反应是NaOH+HCl=NaCl+H2O,溶剂的质量增多,增多的质量是参加反应的NaOH溶液中溶剂的质量与生成水的质量之和,稀盐酸反应完以后,发生的反应是:CuCl2+2NaOH=Cu(OH)2↓+2NaCl,溶剂增多的质量是参加反应的NaOH溶液中溶剂的质量,当NaOH溶液过量时,溶剂增多的质量是加入NaOH溶液中溶剂的质量,故溶剂质量一开始增加幅度大,后面增加幅度减小,此选项错误;
D. 反应前无NaCl,加入NaOH溶液生成NaCl,等质量的NaOH溶液与两种物质反应生成等质量的NaCl,当NaOH溶液过量时,NaCl的质量不再增多,此选项正确。
故选C。

【题目】某固体混合物可能含有BaCl2、FeCl3、Mg(NO3)2、Na2SO4、CaCO3中的一种或几种,为确定其组成,兴趣小组进行如下探究,请你参与解答相关问题。

(1)分析图可知,固体混合物中不含有的物质是________。加入水后发生反应的化学方程式为____________
(提出问题)过滤所得无色溶液中含有哪些溶质?
(猜想与假设)猜想无色溶液中所含溶质可能为
猜想I: NaCl、Mg(NO3)2;
猜想II: NaCl、BaCl2;
猜想III: NaCl、Na2SO4;
猜想IV: NaCl、Mg(NO3)2、______
猜想V:含有NaCl、Mg(NO3)2、BaCl2。
(实验探究)
实验操作 | 实验现象 |
①取少量无色溶液于试管中,向其中滴加氢氧化钡溶液 | 产生白色沉淀 |
②在①反应后的试管中,加入足量的稀盐酸 | 白色沉淀部分溶解 |
(结论和反思)
(2)根据探究结果可知,猜想______成立, 步骤②沉淀溶解的化学方程式为_________
(3)若步骤②的现象为“白色沉淀全部溶解”,则该实验探究及步骤设计存在不足,因为这种情况下无法判断猜想_____和猜想_____哪个成立。