题目内容
【题目】学习氢氧化钠的化学性质后,小明做如下实验:(提示:氯化镁溶液为无色,不能使酚酞试液变红)
实验 | 实验操作 | 实验现象或预期现象 | 结论或解释 |
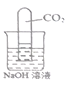
Ⅰ |
| 现象:______________ | 二氧化碳与氢氧化钠发生化学反应,该反应 方程式为__________ |
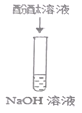
Ⅱ |
| 溶液由无色变为红色 | 结论:_____________________________ |
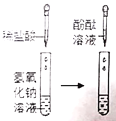
Ⅲ |
| 加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色。 | 盐酸与氢氧化钠未发生化学反应 |
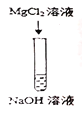
Ⅳ |
| 有白色沉淀生成 | 生成沉淀的原因(用化学方程式解释) _________________ |
Ⅴ | 1.将II、III、IV三支试管中的物质倒入一个洁净的烧杯中 | 烧杯中出现白色沉淀,静置,上层清液无色 | 上层清液中溶质的成分为 __________ (除指示剂外) |
2.取少量上层清液于试管中,滴入_____溶液,可探知该清液中溶质成分 | 可能出现的现象为:________________ |
(1)请补充表格.①~⑦的内容。
(2)小军认为小明实验I操作设计不足以说明二氧化碳与氢氧化钠发生化学反应,应做的改进是_____
(3)小亮认为小明实验III
(4)小琳同学提出,实验III如果不用酚酞指示剂,可向盐酸和氢氧化钠混合后的溶液中加入某些物质,根据相应的现象来判断反应是否发生。下列分析正确的有_________
A 加入Na2CO3溶液,如果不产生气泡,能证明反应发生。
B 加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
C 加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
【答案】试管内液面上升 CO2+2NaOH=Na2CO3+H2O 氢氧化钠溶液呈碱性,能使酚酞溶液变红 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 氢氧化钠 出现白色沉淀 NaCl和MgCl2 另取一套相同的装置,将氢氧化钠溶液改为等体积的水,做对比实验 氢氧化钠溶液过量时也能使酚酞溶液变红 溶液红色褪去 氢离子和氢氧根离子反应生成水分子 ABC
【解析】
本题涉及碱与非金属氧化物、指示剂、酸、盐的反应,而且需要结合题中多种信息才能回答正确。
(1)①二氧化碳与氢氧化钠反应,试管内气压减小,试管内液面上升,②二氧化碳与氢氧化钠反应生成碳酸钠和水;
③由于溶液由无色变为红色,可知氢氧化钠溶液呈碱性,能使酚酞溶液变红;
④氢氧化钠与氯化镁反应生成氢氧化镁白色沉淀和氯化钠;
⑤实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液无色;溶质可能两种:①NaCl;②NaCl和MgCl2;取少量上层清液于试管中,滴加氢氧化钠溶液,出现白色沉淀,证明猜想②正确;
(2)由于二氧化碳能溶于水,故不足以说明二氧化碳与氢氧化钠发生化学反应,可换用等体积的水做对比实验的方法;
(3)氢氧化钠溶液过量时也能使酚酞溶液变红,故小亮认为小明实验III的结论不正确,当盐酸与氢氧化钠恰好反应时时,溶液呈中性,酚酞溶液呈无色,酸与碱反应的实质是氢离子和氢氧根离子反应生成水分子;
(4)A、加入Na2CO3溶液,如果不产生气泡,说明盐酸发生了反应,能证明反应发生;
B、加入CuSO4溶液,如果不产生蓝色沉淀,说明氢氧化钠发生了反应,能证明反应发生;
C、加入紫色石蕊溶液,如果溶液呈紫色,说明氢氧化钠发生了反应,能证明反应发生。