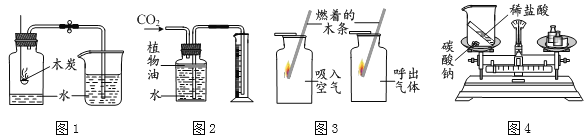
题目内容
【题目】据统计,我国每年报废的手机超过 1 亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有 Sn、Fe、Cu、Au、Ag 等金属。如图是某工厂回收其中部分金属的流程图。( 假设流程图中各反应均恰好完全反应。已知: 2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是_______ ;步骤②~⑤都涉及到的操作是_______ ,其中用到的金属仪器是 ____ 。滤渣 1 中含有的金属是____ (选填字母)。
A Cu、Sn、Au、Pd B Cu、Au、Ag、Pd
C Sn、Au、Ag、Pd D Cu、Sn、Au、Ag
(2)已知 Sn 的化合价为+2 价,则步骤③反应的化学方程式为________ 。
(3)步骤⑥回收的纯净物 B 是________ (写名称)。
【答案】H2 过滤 铁架台 B SnSO4+Fe=FeSO4+Sn 硫酸亚铁
【解析】
金属板加入足量的稀硫酸得到滤渣1和滤液1,滤渣1中加入稀硫酸、氧气控制温度加热,得到银、金和滤液3,滤液3中加入铁粉会生成红色固体A,所以A是铜,滤渣1中含有银、金、铜,滤液3是硫酸铜,滤液4是硫酸亚铁,所以铁、锡排在氢之前,滤液1中加铁得到硫酸亚铁和滤渣2,所以滤渣2中是锡。
由分析可知:(1)步骤②中产生的气体是H2,步骤②~⑤都是将金属从溶液中分离出来,所以涉及到的操作是过滤,其中用到的金属仪器是铁架台,滤渣1中含有的金属是银、金、铜;
(2)步骤③的反应是硫酸锡和铁反应生成硫酸亚铁和锡,化学方程式为:SnSO4+Fe═FeSO4+Sn
(3)步骤⑥回收的纯净物B是硫酸亚铁。

【题目】学习氢氧化钠的化学性质后,小明做如下实验:(提示:氯化镁溶液为无色,不能使酚酞试液变红)
实验 | 实验操作 | 实验现象或预期现象 | 结论或解释 |
Ⅰ |
| 现象:______________ | 二氧化碳与氢氧化钠发生化学反应,该反应 方程式为__________ |
Ⅱ |
| 溶液由无色变为红色 | 结论:_____________________________ |
Ⅲ |
| 加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色。 | 盐酸与氢氧化钠未发生化学反应 |
Ⅳ |
| 有白色沉淀生成 | 生成沉淀的原因(用化学方程式解释) _________________ |
Ⅴ | 1.将II、III、IV三支试管中的物质倒入一个洁净的烧杯中 | 烧杯中出现白色沉淀,静置,上层清液无色 | 上层清液中溶质的成分为 __________ (除指示剂外) |
2.取少量上层清液于试管中,滴入_____溶液,可探知该清液中溶质成分 | 可能出现的现象为:________________ |
(1)请补充表格.①~⑦的内容。
(2)小军认为小明实验I操作设计不足以说明二氧化碳与氢氧化钠发生化学反应,应做的改进是_____
(3)小亮认为小明实验III
(4)小琳同学提出,实验III如果不用酚酞指示剂,可向盐酸和氢氧化钠混合后的溶液中加入某些物质,根据相应的现象来判断反应是否发生。下列分析正确的有_________
A 加入Na2CO3溶液,如果不产生气泡,能证明反应发生。
B 加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
C 加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |

A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤
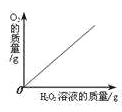
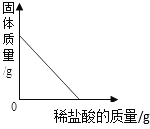
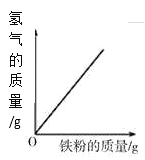
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
A.向一定量的二氧化锰中加入过氧化氢溶液 | B.将铁钉加入硫酸铜溶液中 | C.向一定量的大理石(杂质不参加反应)中加入足量的稀盐酸 | D.向一定质量的稀盐酸中加入足量铁粉 |
A. A B. B C. C D. D