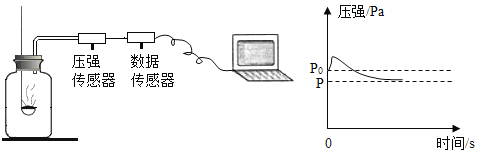
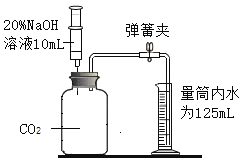
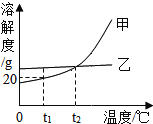
题目内容
【题目】钢铁是使用最多的金属材料.
(1)铁制品锈蚀的过程,实际上是铁与空气中的_______发生化学反应的过程,阻止铁锅锈蚀的一种方法是______________。
(2)用磁铁矿(主要成分是![]() )炼铁的化学方程式为____________。生铁和钢是两种铁合金,从组成上看,二者的________不同,生铁比纯铁_________(填“硬”或“软”).
)炼铁的化学方程式为____________。生铁和钢是两种铁合金,从组成上看,二者的________不同,生铁比纯铁_________(填“硬”或“软”).
【答案】水、氧气 保持锅的干燥 Fe3O4+4CO![]() 3Fe+4CO2 含碳量 硬
3Fe+4CO2 含碳量 硬
【解析】
(1)铁制品锈蚀的原因是铁跟空气中的水、氧气等发生化学反应生成了铁锈;阻止铁锅锈蚀的一种方法是:保持锅的干燥。
(2)用磁铁矿炼铁的化学方程式为Fe3O4+4CO![]() 3Fe+4CO2;生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,主要成分均为铁,主要区别是含碳量不同;生铁是铁和碳的合金,合金比组分的硬度更高,所以生铁比纯铁硬度大。
3Fe+4CO2;生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,主要成分均为铁,主要区别是含碳量不同;生铁是铁和碳的合金,合金比组分的硬度更高,所以生铁比纯铁硬度大。

【题目】某化学兴趣小组在探究物质燃烧条件时,做了如下实验:
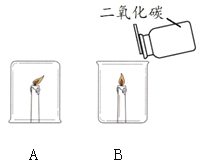
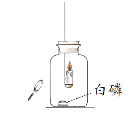
同学们发现两支蜡烛都熄灭了。
(提出问题)实验A中蜡烛熄灭的原因是什么?
(猜想与假设)
猜想1:烧杯内的氧气被耗尽,所以蜡烛熄灭。
猜想2:烧杯内的二氧化碳含量升高,所以蜡烛熄灭。
(进行实验)
实验I:点燃蜡烛,塞紧胶塞。待蜡烛熄灭后,用放大镜照射白磷。观察到白磷燃烧。
实验II:经检测,实验A中,蜡烛熄灭时,烧杯内二氧化碳的体积分数约为3%。在集气瓶中按照一定的体积比收集气体,分别放入燃烧的蜡烛和燃烧的红磷,实验记录如下:
V(O2):V(CO2) | 蜡烛 | 红磷 |
1:4 | 燃烧 | 燃烧 |
1:5 | 燃烧 | 燃烧 |
1:6 | 熄灭 | 燃烧 |
1:9 | 熄灭 | 燃烧 |
(解释与结论)
(1)实验B中蜡烛熄灭,体现二氧化碳的化学性质是_______。
(2)实验I的目的是_______。
(3)写出红磷燃烧的化学方程式_______。
(4)实验II证明猜想2错误,依据的实验现象是_______。
(5)结合实验I与实验II,得出的实验结论是_______。
(实验反思)
(6)通过此实验,同学们对物质燃烧的条件有了新的认识,如_______。
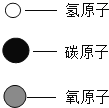
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。高温下,甲和乙反应生成丙和丁,结合表中信息判断下列说法正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
化学式 | ? | C | CO | H2 | |
微观 示意图 |
|
|
| ? |
A. 甲的化学式为CO2 B. 保持丙化学性质的最小粒子为碳原子和氧原子
C. 反应物和生成物中都有化合物 D. 反应生成丙与丁的分子个数比为2:1