题目内容
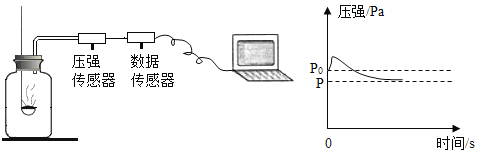
【题目】(1)为测定空气中氧气的含量,左下图所示实验装置气密性良好,与集气瓶相连的压强传感器等电子设备可将集气瓶内气体压强精确地记录并保存下来;右下图是实验过程中集气瓶内的压强变化曲线。
①写出红磷燃烧的化学方程式_______________。
②根据上图请描述红磷燃烧开始后,集气瓶内压强随时间变化的情况是______,原因是_________。
③若燃烧匙内所装红磷的量偏少,则测出的氧气的含量偏______(填“低”或“高”)。
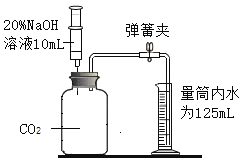
(2)小明用容积为125 mL的集气瓶通过向上排空气法收集二氧化碳气体。验满后小明认为这瓶气体不是纯净的,为测定这瓶气体中二氧化碳的体积分数,设计如图装置进行实验(装置气密性良好)。
(查阅资料)氢氧化钠(NaOH)可以与二氧化碳反应,生成碳酸钠(Na2CO3)和水,碳酸钠易溶于水,写出反应的化学方程式_________________。
(实验操作)将注射器内的氢氧化钠溶液全部注入集气瓶中,轻轻地稍微振荡集气瓶,打开弹簧夹,量筒内的水沿导管流入集气瓶,实验结束后,经检验集气瓶内氢氧化钠有剩余,并测得集气瓶外剩余的水35 mL。
(实验结果)这瓶气体中二氧化碳的体积分数=________________。
(反思与评价)该实验还存在误差,原因可能是_______________。
【答案】4P+5O2![]() 2P2O5 压强先增大后减小 红磷燃烧放出热量,反应消耗氧气,反应后温度降低 低 CO2+2NaOH=Na2CO3+H2O 80% 塞瓶塞时部分二氧化碳逸出集气瓶
2P2O5 压强先增大后减小 红磷燃烧放出热量,反应消耗氧气,反应后温度降低 低 CO2+2NaOH=Na2CO3+H2O 80% 塞瓶塞时部分二氧化碳逸出集气瓶
【解析】
(1)
①红磷燃烧产生大量白烟,生成五氧化二磷,方程式故填4P+5O2![]() 2P2O5;
2P2O5;
②由图可知压强先增大后减小,故填压强先增大后减小;红磷燃烧放出热量使集气瓶内气体体积膨胀,所以压强先变大,反应结束后,集气瓶内氧气被消耗,温度逐渐降低,压强减小,故填红磷燃烧放出热量,反应消耗氧气,反应后温度降低;
③若红磷的量不足,不能耗尽集气瓶内氧气,使测得的结果偏低,故填低;
(2)
[查阅资料]
氢氧化钠(NaOH)与二氧化碳反应生成碳酸钠(Na2CO3)和水,碳酸钠易溶于水,反应的化学方程式故填CO2+2NaOH=Na2CO3+H2O;
[实验结果]
集气瓶容积为125mL,由题意知进入集气瓶液体体积为(125+10-35)mL=100mL,即反应掉的二氧化碳体积,所以这瓶气体中二氧化碳的体积分数=![]() ×100%=80%,故填80%;
×100%=80%,故填80%;
[反思与评价]
装置气密性良好,实验还存在误差,可能会有部分二氧化碳在塞瓶塞时逸出集气瓶,故填塞瓶塞时部分二氧化碳逸出集气瓶。

 阅读快车系列答案
阅读快车系列答案【题目】三氯化铁(FeCl3)用于金属蚀刻等。化学兴趣小组想把铁燃烧产物转化成FeCl3。 请根据装置如图回答问题:
(1)写出铁在氧气中燃烧的化学方程式____。
探究一:铁丝在氧气中燃烧为什么会火星四射?
(查阅资料)
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时 的现象 | 剧烈燃烧,发白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | 大量火星 |
(2)由上表可知铁丝燃烧能否产生火星与该物质____有关。
探究二:铁丝燃烧时溅落的黑色物质的成分
(查阅资料)Fe3O4能与稀盐酸反应生成可溶于水的FeCl2和FeCl3,溶液呈黄色。反应的方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O。
(实验探究)将溅落的黑色物质碾碎,加入足量稀盐酸。
(3)观察到黑色固体逐渐溶解,溶液变成黄色,同时有气泡生成,写出产生气泡的化学方程式____。
(实验结论)
(4)由以上现象可得,铁燃烧时溅落的黑色物质含有____。
(5)反应完全后,发现还有固体残渣,你认为该残渣可能是____。
探究三:三氯化铁的制取与应用
(查阅资料)①通入Cl2可将FeCl2溶液转化成FeCl3溶液。
②废铜电路板上的铜与FeCl3溶液反应生成FeCl2和CuCl2。
③FeCl3能使KSCN溶液变红色,而FeCl2与CuCl2不能。
将探究二所得剩余物,通过分步实验,操作过程中氯化铁的质量变化如图16:
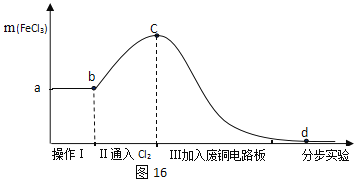
(6)操作Ⅰ可除去固体残渣,该操作的名称是____。
(7)通过操作Ⅱ,氯化铁的质量增加的原因是____(用化学方程式来表示)。
(8) 通过操作Ⅲ,得到d溶液,检验d溶液中是否还含有氯化铁的方法是____。